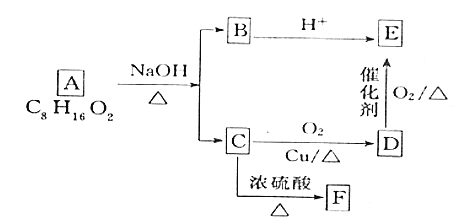
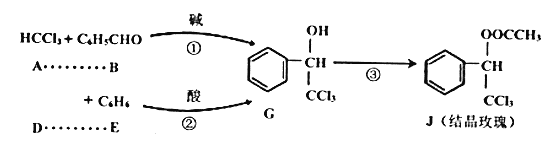
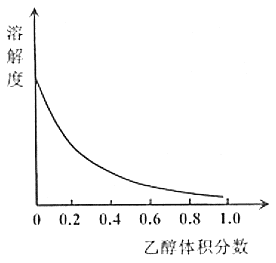
-
下列过程不涉及氧化还原反应的是( )
A.黑火药的爆炸
B.丹砂(
)烧之成水银,积变又成丹砂
C.利用明矾溶液清除铜绿
D.湿法炼铜
难度: 简单查看答案及解析
-
天津属于沿海城市,下列与海洋有关说法正确的是( )
A.从海水中提取
单质,最后一步电解
饱和溶液,就可制得金属镁
B.海水经过一定生产过程可以制造出杀灭病毒的84消毒液
C.从海带中提取碘,含
的溶液可以用酒精萃取
D.海水中富集的元素氯在目前已知的元素中电负性最强
难度: 中等查看答案及解析
-
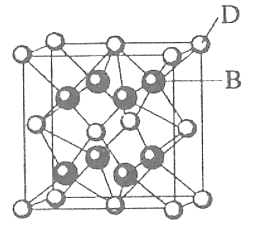
下列各项中所列物质与所属类别对应正确的是( )
A.电解质:氧化钠、石墨、硫酸
B.混合物:盐酸、冰水混合物、氢氧化铁胶体
C.共价晶体:金刚石、
D.一元酸:醋酸、苯甲酸、高锰酸
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.利用键长及键能的数据可判断:稳定性
B.金属的电子气理论,可以解释金属易导电易腐蚀的原因
C.化学反应过程中一定有化学键的变化,这是反应过程中能量变化的本质原因
D.活化能越大就代表化学反应需要吸收或放出的能量就越大
难度: 中等查看答案及解析
-
下列选项错误的是( )
A.氧化铁溶于过量氢碘酸:
B.足量氨水吸收少量二氧化碳气体:
C.常温下,水电离出的
,则
可能会大量共存
D.在明矾溶液中,
不能大量共存
难度: 中等查看答案及解析
-
根据已有知识判断下列说法正确的是( )
A.若X是第四周期中的一种“类硅”元素,则X单质不易与水反应
B.若
与
电子层结构相同,则原子序数
,离子半径
C.若①氯化钠溶液与②氯化铵溶液浓度相等,则常温下两种溶液中的Kw:②>①
D.若反应
在一定条件下能够自发进行,则反应的
难度: 简单查看答案及解析
-
下列实验操作或分析正确的是( )
A.用湿润的
试纸测盐酸的
B.检验淀粉是否水解,可以向淀粉溶液中加入稀
,加热一段时间,冷却后加入新制
,煮沸,观察是否有红色沉淀生成
C.乙醇和乙酸在浓硫酸作用下,酯化制得乙酸乙酯,提纯乙酸乙酯需要经过水、氢氧化钠溶液洗涤
D.用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏高
难度: 简单查看答案及解析
-
下列关于化学平衡的判断正确的是( )
A.化学平衡向正反应方向移动,反应物的转化率不一定增大
B.对于放热反应,降低温度将缩短反应达到平衡的时间
C.对于有气体参加的反应,改变反应体系的压强,化学平衡一定移动
D.同一可逆反应,在温度
时,反应对应的平衡常数
,则说明该反应为放热反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下,
固体在
溶液中的
比在
中的
大
B.恒温恒容的密闭容器中,某储氢反应:
,当容器内气体压强保持不变时,反应达到化学平衡
C.铝-空气燃料电池,以
溶液为电解液时负极反应为:
D.常温下,相同浓度的碳酸钠与碳酸氢钠的混合溶液中离子浓度的大小顺序为:
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氨基酸为高分子化合物,分子中既有-COOH又有-NH2,可以发生缩聚反应
B.苯甲酸重结晶主要经过热溶、趁热过滤、蒸发、结晶等几步
C.1mol
 最多和6molNaOH发生反应
最多和6molNaOH发生反应D.
 经酸性水解,得到两种产物
经酸性水解,得到两种产物难度: 中等查看答案及解析
-
电解
溶液,原理如图所示。下列说法正确的是( )

A.随着电解的进行,阴极区溶液的pH变小
B.
从阴极穿过交换膜向阳极移动
C.若利用可逆反应原电池做此电解装置的电源,当原电池中发生的反应达平衡时,该电解装置不会停止工作
D.阳极电极反应式:
难度: 中等查看答案及解析
-
室温下,用等浓度的NaOH溶液,分别滴定浓度均为0.1 mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( )

A.等浓度的三种酸中和等量的NaOH需要三种酸的体积:V(HA)>V(HB)>V(HD)
B.从滴定开始至pH=7时,三种溶液中水的电离程度逐渐增大
C.滴定至P点时,溶液中:c(HB)+c(H+)=c(B-)+c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
难度: 中等查看答案及解析