-
据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫磺)能化金银钢铁,奇物”。硫与某些金属单质化合所得的产物可能是()
A.AlS B.AgS C.CuS D.FeS
难度: 简单查看答案及解析
-
硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是 ( )
A. 浓硝酸使紫色石蕊试液先变红后褪色——酸性和强氧化性
B. 不能用稀硝酸与锌反应制氢气——强氧化性
C. 要用棕色瓶盛装浓硝酸——不稳定性
D. 稀硝酸能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
难度: 简单查看答案及解析
-
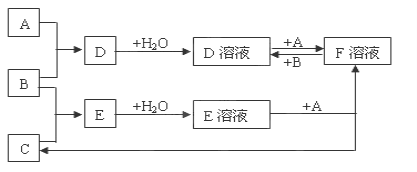
高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料.它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:
SiO2
Si(粗)
SiHCl3
Si(纯)
下列说法正确的是()
A.步骤①的化学方程式为:SiO2+C
Si+CO2↑
B.SiO2既能与HF反应,又能与NaOH反应,所以SiO2属于两性氧化物
C.高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D.含硅化合物硅酸钠属于盐类,不属于碱,可以保存在磨口玻璃塞试剂瓶中
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是()
A.Al2O3熔点高,可用作耐高温材料
B.NH4HCO3受热易分解,可用作氮肥
C.Fe2(SO4)3易溶于水,可用作净水剂
D.SO2具有氧化性,可用于漂白纸浆
难度: 简单查看答案及解析
-
同温、同压下,等体积的NH3和CH4两种气体,下列有关说法错误的是()
A.所含分子数目相同 B.质量之比为16:17
C.所含氢原子物质的量之比为3:4 D.密度之比为17:16
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是()
A.1 mol硫单质在过量氧气中完全燃烧产生NA个SO3分子
B.5.4 g铝单质与足量NaOH溶液反应,转移电子数为0.6NA
C.标准状况下,36 g H2O中含有氧原子数为1 mol
D.标准状况下,22.4 L SO3中含有氧原子数为3NA
难度: 中等查看答案及解析
-
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是()
物质
组别
甲
乙
丙
A
Al
HCl
NaOH
B
NH3
CuO
HNO3
C
SiO2
NaOH
HF
D
SO2
Na2SO3
BaCl2
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是()
A.因为SO2具有漂白性,所以它能使溴水、石蕊试液褪色
B.湿润的氯气具有漂白作用,它能使石蕊试液先变红色再褪色
C.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
D.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性,能使蔗糖炭化
难度: 简单查看答案及解析
-
按照氟、氯、溴、碘的顺序,下列递变规律中正确的是()
A.F-、Cl-、Br-、I-的还原性逐渐增强 B.与H2反应越来越容易
C.单质的熔、沸点逐渐降低 D.单质的氧化性逐渐增强
难度: 简单查看答案及解析
-
检验溶液中是否含有某种离子,下列操作方法正确的是()
A.向某溶液中加稀BaCl2,产生白色沉淀,再加入HCl溶液,沉淀不溶解,证明有SO
B.向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO
C.向某溶液中先加入Ba(NO3)2溶液无明显现象,再加入硝酸酸化的AgNO3溶液产生白色沉淀,证明有Cl-
D.向某溶液中加入浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH
难度: 中等查看答案及解析
-
火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某同学欲检验火柴燃烧后的气体中是否含有CO2,他应采用下列方法中的 ()
A.通入澄清的石灰水中 B.先通入足量NaHCO3溶液中,再通入澄清石灰水中
C.通入品红溶液中 D.先通入足量溴水中,再通入澄清石灰水中
难度: 中等查看答案及解析
-
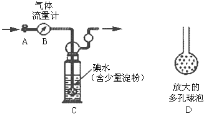
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
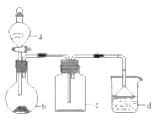
选项
a中的物质
b 中的物质
c中收集的气体
d 中的物质
A
浓氨水
CaO
NH3
H2O
B
浓盐酸
MnO2
Cl2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓硫酸
Na2SO3
SO2
NaOH溶液
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
某实验过程如图所示:则图③的试管中的现象是()

A.无明显现象,因稀H2SO4不与铜反应
B.铜片溶解,产生无色气体,该气体在试管口变为红棕色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体遇到空气不变色
难度: 简单查看答案及解析
-
某同学用下列装置制备并检验Cl2的性质,下列说法正确的是 ( )
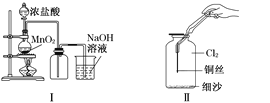
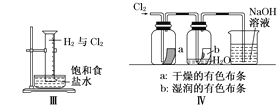
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B.Ⅱ图中:生成蓝色的烟
C.Ⅲ图中:用日光照射量筒,量筒中会产生大量白雾,液面会迅速上升
D.Ⅳ图中:a中有色布条褪色,b中不褪色
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是()
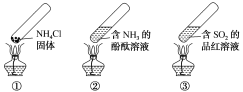
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现SO2的氧化性
D.三个“封管实验”中所发生的化学反应都是可逆反应
难度: 简单查看答案及解析
-
“绿色化学实验”已走进课堂,下列说法符合“绿色化学”的是()
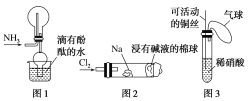
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①③④ D.①②④
难度: 中等查看答案及解析
-
用以下三种途径来制取相同质量的硝酸铜:①铜跟稀硝酸反应②铜跟浓硝酸反应,③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是()
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量:途径①=途径②=途径③
D.所消耗硝酸的物质的量:途径①>途径②>途径③
难度: 简单查看答案及解析
-
下列离子方程式或化学方程式中正确的有()
①向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
②向次氯酸钙溶液中通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
③将CO2气体通过过氧化钠固体:2CO2+2Na2O2=2Na2CO3+O2
④将SO2气体通过过氧化钠固体:2SO2+2Na2O2=2Na2SO3+O2
⑤氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+HCO
=CaCO3↓+H2O
⑥在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO
=3Fe3++2H2O+NO↑
⑦硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-=Fe(OH)3↓
A.2项 B.3项 C.4项 D.5项
难度: 中等查看答案及解析
-
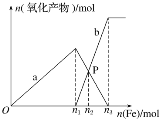
铜和镁的合金4.8g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()
A.8.71g B.8.455g
C.8.51g D.7.04g
难度: 中等查看答案及解析
-
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO2和O2②NO和NO2③NH3和N2,现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为
、
、
,则下列关系正确的是()
A.
B.
C.
D.
难度: 中等查看答案及解析
-
X、Y、Z是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现如图所示转化关系的是( )
X
Y
Z
箭头上所标数字的反应条件
A.
NO
NO2
HNO3
①常温遇氧气
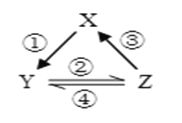
B.
Cl2
NaClO
HClO
②通入CO2
C.
Na2O2
NaOH
NaCl
③加入H2O2
D.
Al2O3
NaAlO2
Al(OH)3
④加NaOH溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
工业上常用NOx+NH3
N2+H2O,使NOx转化为无毒的N2,现有NO、NO2的混合气体3.0 L,可与3.5 L相同状况的NH3恰好完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是()
A.1∶3 B.2∶1
C.3∶1 D.1∶1
难度: 中等查看答案及解析
-
下列说法正确的有( )个
①浓硫酸有强氧化性,所以浓硫酸不可以用于干燥CO和SO2等具有还原性的气体;
②将少量的铜加入浓硫酸中加热,很快能观察到溶液变为蓝色;
③常温下,可以用铁片鉴别浓硫酸和稀硫酸;
④50mL 18.4mol/L的浓硫酸与足量的铜充分反应,可以产生0.46mol的SO2;
⑤浓盐酸、浓硫酸两溶液敞口放置一段时间,浓度会下降的原因相同
⑥铜片溶于热的浓硫酸,体现了浓硫酸的酸性和强氧化性
A.1个 B.2个
C.3个 D.4个
难度: 中等查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()
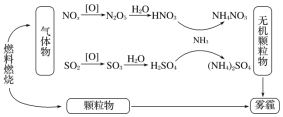
A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵
C.雾霾的形成与过度施用氮肥有关 D.NH3是形成无机颗粒物的催化剂
难度: 简单查看答案及解析