-
化学与生活、社会发展息息相关,下列有关说法不正确的是
A. 将海水中的镁转化为氯化镁,再电解熔融氯化镁可制得金属镁
B. 稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张
C. 芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程涉及到化学变化
D. 《新修本草》中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑙璃……烧之赤色……”这里的赤色是析出了Cu单质
难度: 中等查看答案及解析
-
环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是
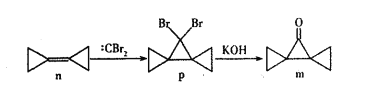
A.n分子中所有原子都在同一个平面上
B.n和:CBr2生成p的反应属于加成反应
C.p分子中极性键和非极性键数目之比为2:9
D.m分子同分异构体中属于芳香族化合物的共有四种
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列叙述正确的是
A. Cu与浓硝酸反应生成4.6gNO2和N2O4混合气体时,转移电子数为0.1NA
B. 标准状況下,2.24L己烷中共价键的数目为1.9NA
C. 在0.1mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA
D. 34gH2O2中含有的阴离子数为NA
难度: 中等查看答案及解析
-
下列实验中,与现象对应的结论一定正确的是
选项
实验
现象
结论
A.
常温下,将CH4与Cl2在光照下反应后的混合气体通入石蕊溶液
石蕊溶液先变红后褪色
反应后含氯的气体共有2种
B.
向10 mL0.1mol/L NaOH溶液中 先后加入1mL浓度均为0.1mol/L的MgCl2和CuCl2溶液
先生成白色沉淀,后生成蓝色沉淀
Cu(OH)2溶解度小于 Mg(OH)2
C.
加热NH4HCO3固体,在试管口放一小片湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3溶液显碱性
D.
将绿豆大小的金属钠分别加入水和乙醇中
前者剧烈反应
水中羟基氢的活泼性大于乙醇的
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
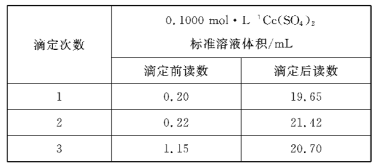
根据下列图示所得出的结论正确的是
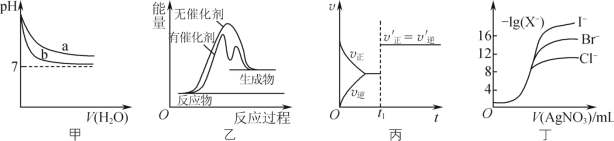
A.图甲表示pH相同的NaOH溶液与氨水稀释过程pH的变化,曲线b对应氨水
B.图乙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C.图丙表示CO(g)+Cl2(g)=COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
D.图丁表示用0.0100mol·L-1的硝酸银标准溶液滴定浓度均为0.1000mol·L-1Cl-、Br-及I-的混合溶液时,先沉淀的是Cl-
难度: 中等查看答案及解析
-
酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数分别为Kal(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.H2SO4在冰醋酸中的电离方程式为H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B.H2SO4在冰醋酸中:
=c(HSO4-)+2c(SO42-)+c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸,
的值减小
难度: 中等查看答案及解析
-
探究Na2O2与水的反应,实验如图:(已知:H2O2
H+ + HO2-、HO2-
H+ + O22-)下列分析不正确的是
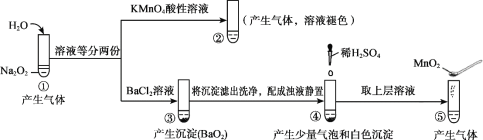
A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D.通过③能比较酸性:HCl>H2O2
难度: 中等查看答案及解析
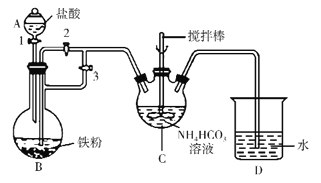
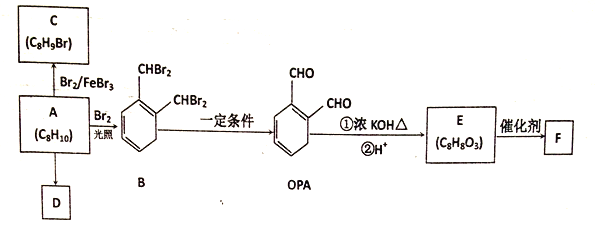

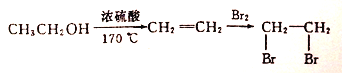 。
。