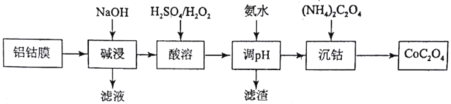
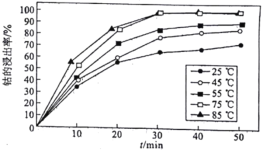
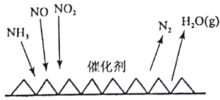
-
化学与人类生活、生产和社会可持续发展密切相关。下列说法不正确的是( )。
A.《本草纲目》中“凡酸坏之酒,皆可蒸烧”,所用的分离操作方法是蒸馏
B.“试玉要烧三日满,辨材须待七年期”,该诗句表明玉的熔点非常高
C.港珠澳大桥的吊绳中含有的超高分子量聚乙烯纤维属于有机高分子化合物
D.我国预计2020年发射首颗火星探测器,阳能电池帆板的材料是二氧化硅
难度: 简单查看答案及解析
-
关于有机物
(
)、
(
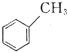 )、
)、(
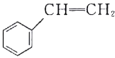 )的说法正确的是( )。
)的说法正确的是( )。A.
和
的一氯代物均有三种结构
B.
和
互为同分异构体,
和
互为同系物
C.
、
、
分子中的所有原子可能在同一平面上
D.
、
、
三种物质均能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
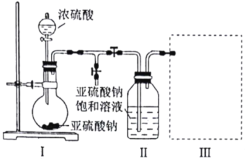
下列实验中,所选装置及实验设计合理的是( )。
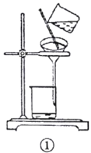
A.用图①所示装置可以除去四氯化碳中混有的碘单质
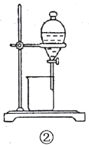
B.用图②所示装置可以分离乙酸乙酯和饱和碳酸钠的混合溶液
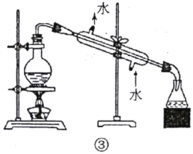
C.用图③所示装置可以分离乙醇和乙酸的混合溶液
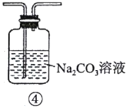
D.用图④所示装置可除去
中混有的少量
难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是( )。
A.盛放烧碱的试剂瓶不能用玻璃塞:
B.用热的纯碱溶液可以清洗油污:
C.酸性
淀粉溶液久置后变蓝:
D.漂白液(有效成分
)与洁厕灵(主要成分盐酸)混合使用产生氯气:
难度: 简单查看答案及解析
-
最新科技研究成果表明磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,该电池放电时的反应为
。某磷酸铁锂电池的切面如下图所示。下列说法不正确的是( )。
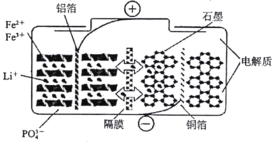
A.放电时,电池负极反应为:
B.充电时,阳极上发生的反应为:
C.放电时,Li+脱离石墨,经电解质嵌入负极
D.充电时,电子从电源负极流出经铜箔流入阴极材料
难度: 中等查看答案及解析
-
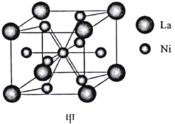
短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可以组成一种分子簇,其分子结构如图所示(球的大小表示原子半径的相对大小),W、X位于不同周期,X原子的最外层电子数是次外层电子数的3倍,Z的族序数等于其周期数,下列说法中正确的是( )。
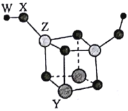
A.W和X可以组成原子个数比为2:1和1:1的离子化合物
B.工业上可采用电解Z的熔融氯化物的方法制得单质Z
C.Z的最高价氧化物对应水化物的碱性比Y的强
D.X、Y、Z三种元素的离子半径由小到大顺序为Z<Y<X
难度: 中等查看答案及解析
-
酸碱中和滴定是中学化学定量分析的一种重要方法。已知在25℃时,取20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,用浓度为0.1000mol/L的NaOH溶液分别进行滴定,滴定曲线如图所示。下列说法不正确的是( )。
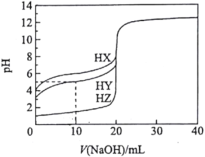
A.在相同温度下,同浓度的三种酸溶液的pH大小顺序为:HZ<HY<HX
B.当V(NaOH)=10mL时,在HY溶液中由水电离出的
C.HY与HZ混合,达到平衡时:
D.根据上述滴定曲线,可计算得Ka(HY)≈10-3
难度: 中等查看答案及解析