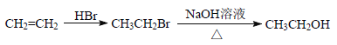-
化学与生产、生活、社会密切相关。下列说法正确的是
A.可用干冰作镁粉爆炸时的灭火剂
B.焊接废旧钢材前,分别用饱和Na2CO3溶液和NH4Cl溶液处理焊点
C.雾、鸡蛋清溶液、石灰乳、食盐水中,分散质粒子直径最小的是雾
D.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L 14CO2含有的中子数为11 NA
B.l mol白磷(P4) 与l mol甲烷所含共价键数目之比为1:1
C.一定条件下0.2 mol SO2与0.2 mol O2充分反应,生成SO3的分子数最多为0.2 NA
D.将1 mol CH3COONa溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目为NA
难度: 中等查看答案及解析
-
下列与有机物的结构、性质有关的叙述不正确的是
A.立方烷(
)的二氯代物有3种,三氯代物也有3种
B.有机物 (CH3)2CHC(CH3)3的名称为2,2,3−三甲基丁烷
C.向鸡蛋清的溶液中加入浓的硫酸钾溶液或福尔马林,蛋白质的性质发生改变并凝聚
D.用CH2(NH2)—COOH和CH3—CH(NH2)—COOH两种氨基酸脱水,最多可以生成4种二肽
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,Z、W两种元素原子序数之和为X元素原子序数的4倍。由这四种元素中的一种或两种组成的三种有色物质与水发生氧化还原反应时,水既不作氧化剂也不作还原剂。下列说法正确的是
A.原子半径:r(Z)>r(X)>r(W)>r(Y)
B.最简单氢化物的沸点为:W>Y
C.X、Y、W分别与氢元素形成的化合物中化学键均为极性共价键
D.这三种有色物质在化学反应中常用作氧化剂
难度: 中等查看答案及解析
-
某小组比较Cl-、Br-、I-的还原性,实验如下:
实验1
实验2
实验3
装置
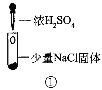
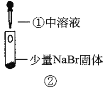
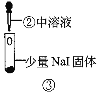
现象
试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟。
溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝。
溶液变深紫色;经检验溶液含单质碘。
下列对实验的分析合理的是
A.实验1中,白烟是(NH4)2SO4
B.根据实验1和实验2判断还原性:Br->Cl-
C.根据实验3判断还原性:I->Br-
D.上述实验利用了浓H2SO4的强酸性、强氧化性等性质
难度: 中等查看答案及解析
-
中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂−空气电池如下图 1,电池的工作原理如下图 2。下列有关说法正确的是
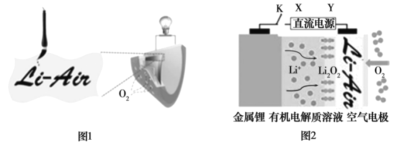
A.放电时,纸张中的石墨作锂电池的正极
B.开关 K 闭合给锂电池充电,金属锂电极上发生氧化反应
C.充电时,空气电极的反应式为: Li2O2 +2e- = 2Li+O2↑
D.电池工作时,电子的流向为:金属锂电极→有机电解质溶液→空气电极
难度: 中等查看答案及解析
-
若定义pC是溶液中微粒物质的量浓度的负对数。常温下,一定浓度的某酸(H2A)的水溶液中pC(H2A)、pC(HA-)、pC(A2-)随着溶液pH的变化曲线如图所示。
下列说法一定正确的是( )
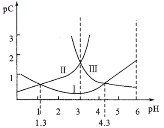
A.pH=3时,c(H2A)=c(A2-)>c(HA-)
B.c(H2A)+c(HA-)+c(A2-)是定值
C.HA-的水解平衡常数为10-12.7
D.任何时候,溶液中都存在:c(H+)=c(OH-)+c(HA-)+2c(A2-)
难度: 困难查看答案及解析
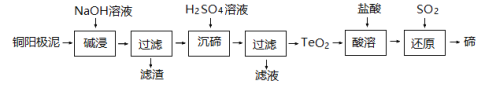
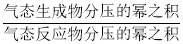 )。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
)。把一定量的PCl5引入一真空瓶内,达平衡后PCl5的分压为2.5×104Pa,则PCl5的分解率为________。
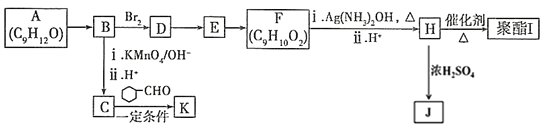
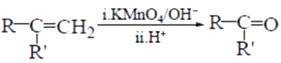 +CO2
+CO2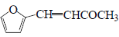 )是一种重要的医药中间体,请参考上述合成路线,设计一条由(CH3)3CCl和
)是一种重要的医药中间体,请参考上述合成路线,设计一条由(CH3)3CCl和