-
预防和灭杀新型冠状病毒是有效控制肺炎传播的重要手段。下列叙述中错误的是
A.佩戴医用外科口罩或N95口罩能有效阻断病毒的传播
B.使用开水蒸煮餐具可使病毒蛋白质变性
C.医用酒精、含氯消毒剂的浓度越高其消毒效果越好
D.能传播新冠病毒的气溶胶的分散剂是空气
难度: 中等查看答案及解析
-
化合物如图的分子式均为C7H8。下列说法正确的是
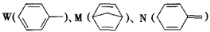
A.W、M、N均能与溴水发生加成反应 B.W、M、N的一氯代物数目相等
C.W、M、N分子中的碳原子均共面 D.W、M、N均能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
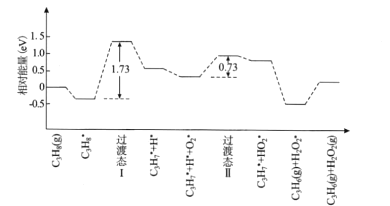
目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是( )
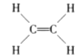
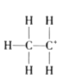
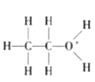
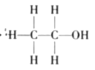
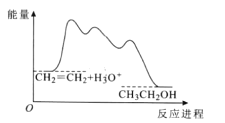
A.①、②、③三步反应均释放能量
B.该反应进程中有两个过渡态
C.第①步反应的活化能最小
D.总反应速率由第①步反应决定
难度: 中等查看答案及解析
-
下列实验中的颜色变化,与氧化还原反应无关的是( )
选项
实验操作
现象
A
AgNO3溶液滴入氯水中
产生白色沉淀,随后淡黄绿色逐渐褪去
B
FeCl3溶液滴入Mg(OH)2浊液中
白色浑浊转化为红褐色沉淀
C
H2C2O4溶液滴入KMnO4酸性溶液中
产生气泡,随后紫色褪去
D
Na块放在坩埚里并加热
发出黄色火焰,生成淡黄色固体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
我国科学家合成了一种新的化合物,其结构式如图所示。该物质中 W、X、Y、Z、M是短周期中常见元素,且原子序数依次增大;已知M元素原子核外电子总数是Y元素原子核外 电子总数的两倍。下列说法中错误的是
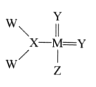
A.由X和Y两种元素形成的化合物有多种
B.W和Z元素位于周期表中同一主族
C.元素的非金属性强弱顺序为:Z>Y>X
D.Y、M元素的气态氢化物沸点高低为:Y>M
难度: 中等查看答案及解析
-
利用固体氧化物电解池(SOEC)可实现乙烷电化学脱氢制乙烯,原理示意图如下所示。下列说法错误的是
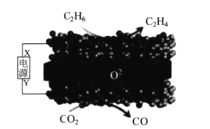
A.X 是电源的正极
B.该装置在工作过程中,O2-在固体氧化物中由下方向上方迁移
C.阴极区发生的反应为:CO2+2e-+2H+=CO+H2O
D.该过程的总反应方程式为:C2H6+CO2=C2H4+CO+H2O
难度: 中等查看答案及解析
-
在室温下,向25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示。下列说法中正确的是
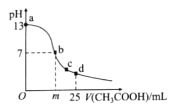
A.在b点的溶液中:m>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
B.在c点的溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.在d点的溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在a一b的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
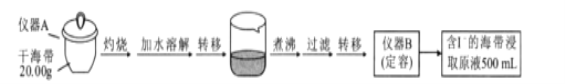
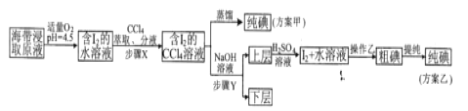
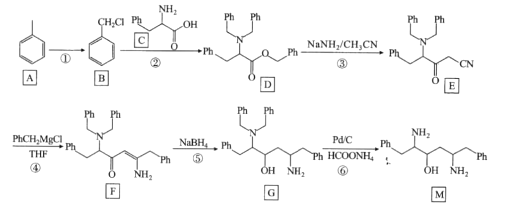
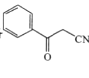 的合成路线(无机试剂任选)。_______________
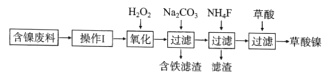
的合成路线(无机试剂任选)。_______________