-
用石墨作电极,电解1mol/L的下列物质的溶液,溶液的pH保持不变的是( )
A.HCl B.NaOH C.Na2SO4 D.NaCl
难度: 中等查看答案及解析
-
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是( )。
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
难度: 简单查看答案及解析
-
下列设备工作时,将化学能转化为热能的是
A.燃气灶 B.锂离子电池 C.硅太阳能电池 D.太阳能集热器
难度: 简单查看答案及解析
-
下列属于弱电解质的物质是
A.HCl B.CH3COOH C.Ba(OH)2 D.KNO3
难度: 简单查看答案及解析
-
下列溶液肯定显酸性的是
A.含 H+的溶液 B.加酚酞显无色的溶液
C.pH<7 的溶液 D.c(H+) >c(OH-)的溶液
难度: 简单查看答案及解析
-
下列事实中,与电化学腐蚀无关的是
A.用铜质铆钉铆接铁板,铁板易被腐蚀
B.为了保护海轮的船壳,常在船壳上附加锌块
C.在空气中,银器表面会生成一层黑色的物质
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
难度: 中等查看答案及解析
-
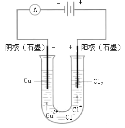
锌铜原电池装置如图所示,下列说法正确的是
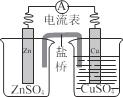
A.铜片作负极
B.电流从锌片流向铜片
C.盐桥的作用是传递电子
D.锌电极的反应式:Zn − 2e-=Zn2+
难度: 简单查看答案及解析
-
对密闭容器中进行的反应:2SO2(g) + O2(g)⇌2SO3(g),若其他条件不变,下列措施会使反应速率减小的是
A.增大压强 B.减小压强 C.升高温度 D.增大 O2 的浓度
难度: 简单查看答案及解析
-
下列操作可以使水的离子积常数Kw增大的是
A.加热
B.通入少量氯化氢气体
C.通入少量氨气
D.加入少量醋酸钠固体
难度: 简单查看答案及解析
-
镉镍可充电电池的充、放电反应如下:
 ,则该电池放电时的负极是
,则该电池放电时的负极是A.
B.
C.
D.
难度: 简单查看答案及解析
-
中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项
A
B
C
D
装置
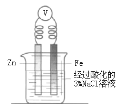
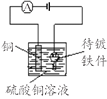
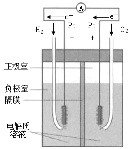
原理
牺牲阳极的阴极保护法
电镀
电解CuCl2溶液
氢氧燃料电池
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
对于可逆反应
⇌
,以下相关图像正确的是
A.
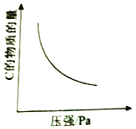 B.
B. 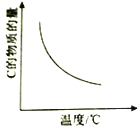 C.
C. 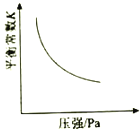 D.
D. 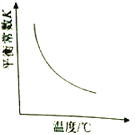
难度: 中等查看答案及解析
-
室温时纯水中存在电离平衡:H2O⇌H++ OH-。下列叙述正确的是
A.升高温度,水的电离程度增大,c(H+)增大,pH<7,溶液显酸性
B.向水中加入少量氨水,平衡逆向移动,抑制水的电离,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,由水电离出的 c(H+)>1×10-7 mol/L
D.向水中加入少量 NH4Cl 固体,
结合水电离出的 OH-,由水电离出的c(H+)>1×10-7 mol/L
难度: 简单查看答案及解析
-
某同学研究浓度对化学平衡的影响,下列说法正确的是
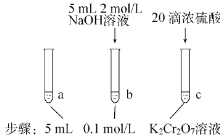
待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管 a 相比,变深。
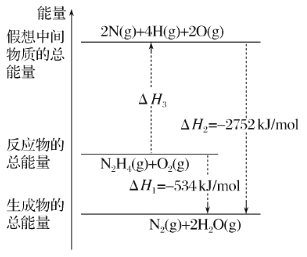
已知:
(aq)(橙色) + H2O(l)⇌2
(aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
A.该反应为氧化还原反应
B.待试管 b 中溶液颜色不变的目的是使
完全反应
C.试管c中的现象说明影响平衡的主要因素是温度
D.该实验不能证明减小生成物浓度平衡正向移动
难度: 简单查看答案及解析