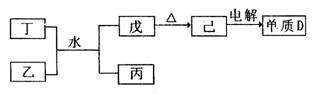
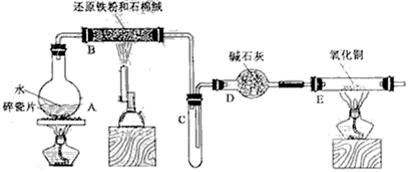
-
日本福岛第一核电站发生严重的核辐射泄漏,日本政府向福岛核电站附近居民发放碘片(12753I),以降低放射性碘对人体的伤害。已知核辐射中放射性碘(碘13153I)的核电荷数为53,则下列说法正确的是
A.核裂变是一种化学变化
B.12753I的质量数为127,原子序数为53,核内有74个中子
C.碘12753I和放射性碘13153I属于同素异形体
D.12753I与13153I是同一种核素
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.饱和FeCl3溶液滴入沸水中:Fe3+ + 3H2O
Fe(OH)3↓+ 3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2+ + SO42-= BaSO4↓
C.钠与水反应:Na+2H2O=Na++H2↑+OH-
D.氯化亚铁溶液中滴入溴水:2Fe2+ + Br2 = 2Fe3+ +2Br-
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.将苯加入浓溴水中,溴水褪色,是因为发生了取代反应
B.Na2CO3溶液可以用来鉴别乙酸、乙醇和苯
C.淀粉和纤维素都可以用(C6H10O5)n表示,因此他们属于同分异构体
D.水煤气、焦炉气、沼气、汽油等都是混合物,而高分子化合物PVC是纯净物
难度: 中等查看答案及解析
-
关于下列装置说法正确的是
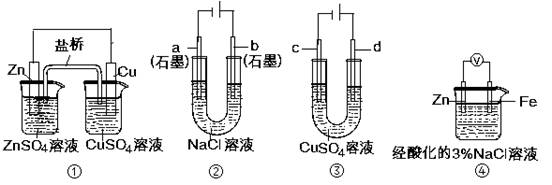
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 中等查看答案及解析
-
下列推断正确的是
A.等质量的NaHCO3和Na2CO3固体中,分别加入足量盐酸,NaHCO3产生的气体多
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.乙醇与金属钠的反应比水与金属钠的反应平缓得多,说明乙醇羟基中的氢原子比水分子中的氢原子活泼
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液最终呈红色
难度: 中等查看答案及解析
-
下列表述Ⅰ和Ⅱ都正确,且存在因果关系的是
表述Ⅰ(因)
表述Ⅱ(果)
A
Si元素位于周期表金属和非金属交界线
Si为非金属元素,其单质是半导体,可做光导纤维的材料
B
“硅胶”是硅酸钠的冻状凝胶经脱水后得到的,多孔、吸附水分能力强
硅胶常用作实验室和袋装食品、瓶装药品等的干燥剂
C
打磨过的铝箔在空气中其表面会很快生成Al2O3薄膜,而且Al2O3的熔点高于Al
打磨过的铝箔在空气中燃烧会失去光泽但熔化的铝并不滴落
D
Fe2O3难溶于水
Fe(OH)3不能通过化合反应直接制得
难度: 中等查看答案及解析