-
氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1+ Q2<2Q3 B.Q1+ Q2>2Q3 C.Q1+ Q2<Q3 D.Q1+ Q2>Q3
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
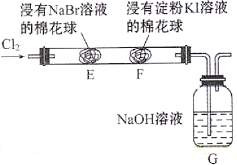
A.E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
难度: 中等查看答案及解析
-
如图是进行气体性质实验的常用装置,下列对有关实验现象的说法中不正确的是
A.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升,试管中黄绿色褪去
B.若水槽中是水,试管中是NO2,可看到试管中液面上升并充满整个试管
C.若水槽中是水(并滴有一定量酚酞),试管中是NH3,可看到液面上升并呈红色
D.若水槽中和试管中都是氯水,光照后可在试管中收集到氧气
难度: 简单查看答案及解析
-
一定量的锌与100mL18.5mol•L﹣1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6L.将反应后的溶液稀释至1L,测得溶液中c(H+)=0.1mol•L﹣1.则生成的气体中SO2和H2的体积比为( )
A.1:2 B.2:1 C.1:4 D.4:1
难度: 中等查看答案及解析
-
某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是( )
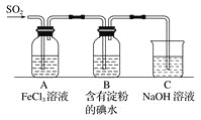
A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B.装置C的作用是吸收SO2尾气,防止污染空气
C.为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
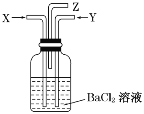
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
难度: 中等查看答案及解析
-
下列表达方式正确的是
A.
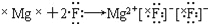 B.质子数为17、中子数为20的氯原子:2017Cl
B.质子数为17、中子数为20的氯原子:2017ClC.HClO的结构式:H—O—Cl D.NH4Cl的电子式:
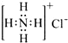
难度: 简单查看答案及解析
-
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
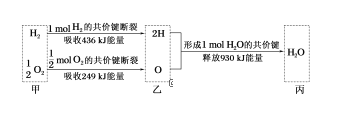
A.H2O分解为H2与O2时放出热量
B.生成1mol H2O时吸收热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.氢气和氧气的总能量小于水的能量
难度: 困难查看答案及解析
-
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
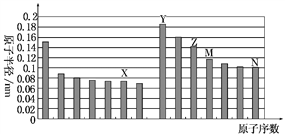
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
难度: 简单查看答案及解析
-
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路由正极流向负极
难度: 中等查看答案及解析
-
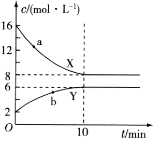
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
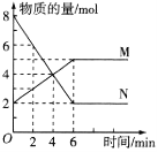
一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
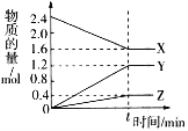
A.反应的化学方程式为2X=3Y+Z
B.t时,正、逆反应都不再继续进行,反应达到化学平衡
C.若t=4,则0~t X的化学反应速率为0.1mol/(L·min)
D.温度、体积不变,t时刻充入1mol He使压强增大,正、逆反应速率都增大
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
难度: 中等查看答案及解析
-
在一定温度下,容积不变的密闭容器中发生反应:
,下列不能说明该可逆反应已经达到平衡状态的是( )
A.混合气体压强不再发生变化 B.混合气体质量不再发生变化
C.反应中CO与
的物质的量之比为1:1 D.生成n mol CO的同时生成n mol
(g)
难度: 简单查看答案及解析
-
可逆反应2NO2(g)
2NO(g)+O2(g),在容积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 简单查看答案及解析
-
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是
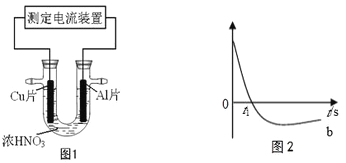
A. 0-t1时,原电池的负极是铜片
B. 0-t1时,正极的电极反应式是2H++2e-=H2↑
C. t1时刻,电流方向发生变化的原因是Al 在浓硝酸中发生钝化,氧化膜阻止了Al进一步反应
D. tl时刻后,电子从铝经过导线流向铜
难度: 困难查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是
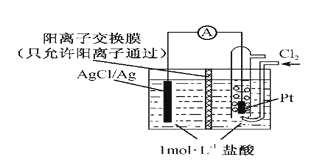
A.正极反应为AgCl +e-=Ag +Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
-
利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,正确的是
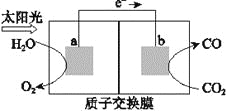
A.该过程是将太阳能转化为化学能的过程
B.电极a表面发生还原反应
C.该装置工作时,H+从b极区向a极区移动
D.该装置中每生成1 mol CO,同时生成1 mol O2
难度: 中等查看答案及解析
-
下列说法中错误的是
①化学性质相似的有机物是同系物 ②分子组成相差一个或几个CH2的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必是同系物 ④具有同一通式的物质属于同系物 ⑤互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似 ⑥相对分子质量相同分子结构不同的有机物互为同分异构体
A.①②③ B.①②④⑤ C.①③④⑤⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
下列物质的沸点按由高到低的顺序排列的是 ( )
①CH3CH2CH3 ②CH3CH2CH2CH3 ③CH3CH2CH2CH2CH3
④
⑤
⑥CH3CH2CH2CH2CH2CH3
A. ⑥③④⑤②① B. ⑥③②①④⑤ C. ⑤④⑥③②① D. ⑥⑤④③②①
难度: 简单查看答案及解析
-
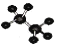
下列说法正确的是( )
A.烷烃的通式为CnH2n+2,随n值增大,碳元素的质量分数逐渐减小
B.
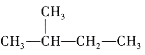 和
和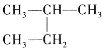 互为同分异构体
互为同分异构体C.乙烷的比例模型为
D.C3H8和C4H10的某种同分异构体的一氯代物数目相同
难度: 简单查看答案及解析
-
已知正四面体形分子E和直线形分子G反应生成四面体形分子L和直线形分子M(组成E的元素的原子序数都小于10,组成G的元素为第三周期元素)的反应过程如图所示,则下列判断正确的是( )
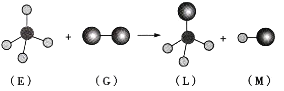
A.常温常压下,L是一种液态有机物
B.E是一种含有非极性键的分子
C.G能使干燥的有色布条褪色
D.该反应是取代反应
难度: 简单查看答案及解析
-
分子式为
的同分异构体共有(不考虑立体异构)
A.6种 B.7种 C.8种 D.9种
难度: 中等查看答案及解析
-
取1 mol甲烷与4 mol氯气放入一密闭容器中,在光照条件下发生反应,充分反应后,容器中各物质的物质的量之和一定为( )
A.1 mol B.4 mol C.5 mol D.无法确定
难度: 简单查看答案及解析