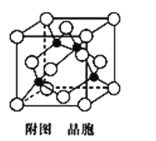
-
下列有关化学与生活、生产的叙述错误的是( )
A.通讯领域中的光导纤维不可长期浸泡在强碱性溶液中
B.采用催化设施,将汽车尾气中的CO和NO转化为无害气体
C.SO2具有氧化性,可用于漂白纸浆
D.常温下,可以用铁制容器来盛装冷的浓硫酸
难度: 简单查看答案及解析
-
对于100mL1mol/L的盐酸与锌粒的反应,采取下列措施能使反应速率加快的是( )
①升高温度
②改用100mL3mol/L的盐酸
③增加锌粒质量
④用等量锌粉代替锌粒
⑤加入少量硫酸铜溶液
A.①③④ B.①②④⑤ C.①②③ D.②③
难度: 简单查看答案及解析
-
实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
A.NH4Cl中的氮元素被还原,发生还原反应
B.NaNO2是氧化剂,NH4Cl是还原剂
C.N2既是氧化产物,又是还原产物
D.每生成2molN2时,转移电子的物质的量为6mol
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.硫酸铜溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
难度: 中等查看答案及解析
-
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )
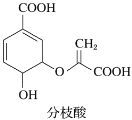
A.可与乙醇、乙酸反应,且反应类型相同
B.分子中含有2种官能团
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,2NA个CO2分子占有的体积为44.8L
B.常温常压下,8.4gNaHCO3含有的Na+数目为0.1NA
C.标准状况下,22.4LH2O含有的分子数为NA
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为NA
难度: 中等查看答案及解析
-
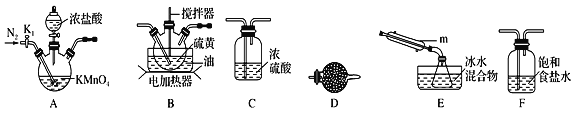
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项
①
②
③
实验结论
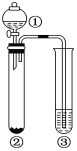
A
浓盐酸
MnO2
NaOH
制氯气并吸收尾气
B
浓硝酸
Na2CO3
Na2SiO3
溶液
酸性:硝酸>碳酸>硅酸
C
稀盐酸
Na2SO3
Ba(NO3)2
溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X的L层电子数是K层的3倍,W所在族序数是周期数的2倍,Y、Z、W的最外层电子数之和为10。下列说法正确的是( )
A.Y可以从溶液中置换出Z单质
B.单核离子半径:W>Z>Y>X
C.Y、Z、W三种元素最高价氧化物对应的水化物两两之间可以反应
D.X和W形成的化合物的水化物一定是强电解质
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是
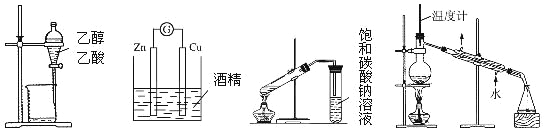
A.除去乙醇中的乙酸 B.形成原电池 C.制取乙酸乙酯 D.石油的蒸馏
难度: 中等查看答案及解析
-
反应4NH3+5O2
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
A.v(NH3)=0.002mol·L-1·s-1 B. v(NO)=0.008mol·L-1·s-1
C. v(H2O)=0.015mol·L-1·s-1 D. v(O2)=0.01mol·L-1·s-1
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A.在无色溶液中:
、
、
、
B.在含大量
的溶液中:
、
、
、
C.在强碱性溶液中:
、
、
、
D.在强酸性溶液中:
、
、
、
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.中子数为10的氧原子:
O
B.Mg2+的结构示意图:
C.硫化钠的电子式:
D.甲酸甲酯的结构简式:C2H4O
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
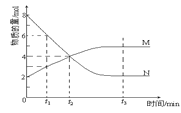
A.反应的化学方程式:2M
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
难度: 简单查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
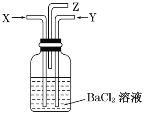
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
叙述Ⅰ
叙述Ⅱ
A
常温下,NaHCO3溶解度比Na2CO3小
往饱和Na2CO3溶液中通入CO2产生沉淀
B
常温下,SiO2与氢氟酸和NaOH溶液均可反应
SiO2是两性氧化物
C
BaSO3难溶于水
SO2气体通入Ba(NO3)2溶液中产生沉淀
D
非金属性:Cl>S
酸性:HClO>H2SO4
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )

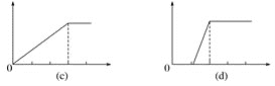
A.①-(d) B.②-(b) C.③-(c) D.④-(a)
难度: 中等查看答案及解析

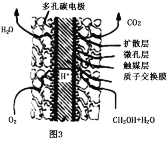

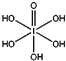 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___HIO4(填“>”、“<”或“=”)。IO