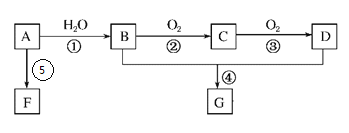
-
下列说法不正确的是
A. 沸点:H2O>HF B. 热稳定性:HF>H2O
C. NCl3、SiCl4分子中每个原子最外层均满足8电子结构 D. 仅由N、H、O三种元素形成的化合物中不可能含离子键
难度: 中等查看答案及解析
-
《淮南万毕术》中有“曾青得铁,则化为铜,外化而内不化”,下列说法中正确的是( )
A. “化为铜”表明发生了氧化还原反应 B. “外化”时化学能转化为电能
C. “内不化”是因为内部的铁活泼性较差 D. 反应中溶液由蓝色转化为黄色
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 标准状况下,2.24 L
中含有碳碳双键数为0.3NA
B. 0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
C. 0.1molCH4与0.1molCl2混合充分光照,生成CH3Cl分子数为0.1 NA
D. 0.1molN2和0.3molH2在高温、高压及催化剂下充分反应,产物的分子数为0.2NA
难度: 中等查看答案及解析
-
下列叙述中错误的是
A.13C和14C属于同一种元素,它们互为同位素
B.H和D是不同的核素,它们的化学性质基本相同
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
难度: 简单查看答案及解析
-
下列物质中含有共价键的离子化合物是( )
①MgF2 ②Na2O2 ③NaOH ④NH4Cl ⑤CO2 ⑥H2O2 ⑦N2
A. ②③④ B. ②④⑤⑦ C. ①②③④⑥ D. ①③⑤⑥
难度: 简单查看答案及解析
-
化学能可与热能、电能等相互转化。下列表述不正确的是( )
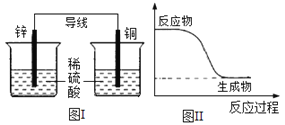
A. 化学反应中能量变化的主要原因是化学键的断裂与形成
B. 能量变化是化学反应的基本特征之一
C. 图I所示的装置能将化学能转变为电能
D. 图II所示的反应为放热反应
难度: 简单查看答案及解析
-
下列事实与元素周期律相关知识无关的是( )
A.向淀粉KI溶液中滴入溴水,溶液变蓝
B.金属钠燃烧呈现黄色火焰,金属钾燃烧呈现紫色火焰
C.CH4、SiH4、GeH4、SnH4的沸点依次升高
D.F2和H2暗处化合爆炸,而Cl2和H2化合需光照或点燃
难度: 中等查看答案及解析
-
根据下面的信息,下列叙述正确的是( )
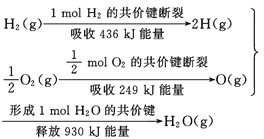
A.2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B.化学反应中能量变化的大小与反应物的质量多少无关
C.1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D.2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
难度: 中等查看答案及解析
-
五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是
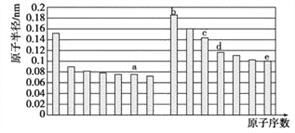
A.c元素的离子半径比e的离子半径小
B.d元素对应的最高价氧化物的水化物酸性比e元素弱
C.b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应
D.a与b两种元素可形成既有离子键又有非极性共价键的化合物
难度: 中等查看答案及解析
-
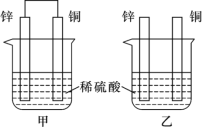
某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是
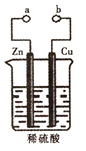
A.a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B.a和b用导线连接时锌片为负极,发生的反应式为:Zn-2e-=Zn2+
C.a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D.无论a和b是否连接,稀硫酸均参与反应
难度: 简单查看答案及解析
-
下列事实不能说明元素的金属性或非金属性相对强弱的是
选项
事实
推论
A
与冷水反应,Na比Mg剧烈
金属性:Na>Mg
B
Ca(OH)2的碱性强于Mg(OH)2
金属性:Ca>Mg
C
SO2与NaHCO3溶液反应生成CO2
非金属性:S>C
D
t℃时,Br2+H2
2HBr Ea=akJ/mol
I2+H2
2HI Ea=bk]/mol (b>a)(Ea为活化能)
非金属性:Br>I
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列叙述正确的是
A.卤素单质的颜色随核电荷数的增大而逐渐加深
B.卤素形成的氢化物稳定性随核电荷数增大而增大
C.碱金属都比水轻
D.碱金属都保存在煤油中
难度: 简单查看答案及解析
-
对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2)=0.8 mol/ (L·s) B.v(A2)=0.4 mol/ (L·s)
C.v(C)=0.6 mol/ (L·s) D.v(B2)=4.2 mol/ (L·s)
难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g)
2HI(g)达到平衡状态时的标志是 ( )
A.混合气体的体积恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
难度: 简单查看答案及解析
-
下列关于苯的叙述正确的是( )
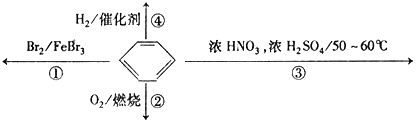
A.反应①为取代反应,有机产物的密度比水小
B.反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟
C.反应③为取代反应,有机产物是一种烃
D.反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳碳双键
难度: 中等查看答案及解析
-
下列关于有机物性质的说法正确的是
A.乙烯和甲烷在一定条件下均可以与氯气反应
B.乙烯和聚乙烯都能使溴水褪色
C.乙烯和苯都能通过化学反应使酸性高锰酸钾溶液褪色
D.乙酸能与钠产生氢气,而乙醇不可以
难度: 中等查看答案及解析
-
把下列四种X溶液分别加入四个盛有10mL2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20mL3mol·L-1的X溶液
B.20℃30mL2mol·L-1的X溶液
C.20℃10mL4mol·L-1的X溶液
D.10℃10mL2mol·L-1的X溶液
难度: 简单查看答案及解析
-
下列关于化学反应限度的说法中正确的是( )
A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的最大限度
B.当一个可逆反应达到平衡状态时,正向反应速率和逆向反应速率相等且等于零
C.平衡状态时,各物质的浓度保持相等
D.化学反应的限度不可以通过改变条件而改变
难度: 简单查看答案及解析
-
下列各反应中属于加成反应的是
A.CH4+2O2
CO2+2H2O
B.CH2=CH2+Br2―→CH2Br—CH2Br
C.CH4+Cl2
CH3Cl+HCl
D.CH3CH2CH2CH3
CH2= CH2+CH3—CH3
难度: 简单查看答案及解析
-
下列各组性质的比较中正确的是
A.酸性:HClO4<H2SO4<H3PO4 B.碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C.稳定性:HF>HCl>PH3>H2S D.原子半径:O>S>Na
难度: 中等查看答案及解析