-
下列对古文献记载内容理解错误的是
A.《开宝本草》中记载了中药材铁华粉的制作方法:“取钢煅作时如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中阴处埋之一百日,铁上衣生,铁华成矣。”中药材铁华粉是醋酸亚铁
B.唐代《真元妙道要略》中有云“以硫磺、雄黄合硝石并蜜烧之,焰起烧手、面及屋舍者”,描述了黑火药制作过程
C.《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作
D.《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
难度: 简单查看答案及解析
-
化合物c的制备原理如下:
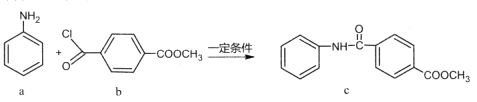
下列说法正确的是
A.该反应为加成反应 B.化合物a中所有原子一定共平面
C.化合物C的一氯代物种类为5种 D.化合物b、c均能与NaOH溶液反应
难度: 中等查看答案及解析
-
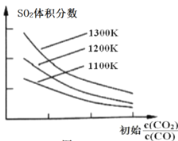
我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是
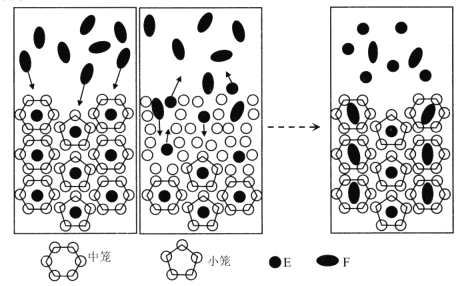
A.E代表CO2, F代表CH4
B.笼状结构中水分子间主要靠氢键结合
C.CO2置换出CH4的过程是化学变化
D.CO2可置换可燃冰中所有的CH4分子
难度: 中等查看答案及解析
-
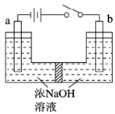
双极电化学法(装置如图)是在传统电解装置中放置了导电性电极BPE,通电时,BPE两端界面产生电势差,生成梯度合金。下列有关说法错误的是
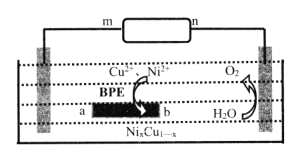
A.m为电源负极
B.BPE的b端比a端的电势高
C.BPE的a端发生的反应为: 2H2O+2e-=H2↑+2OH-
D.BPE的b端到中心的不同位置,能形成组成不同的铜镍合金
难度: 中等查看答案及解析
-
利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是
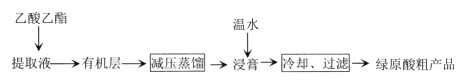
A.常温下,绿原酸易溶于水
B.浸膏的主要成分是绿原酸
C.减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
难度: 中等查看答案及解析
-
“医用酒精”和“84消毒液”混合,产生ZQ、X2W4Y、XW3Q等多种物质,已知W、X、Y、Z、Q为原子序数依次增大的短周期主族元素。下列叙述错误的是
A.简单气态氢化物热稳定性: Y>X
B.W与Z可形成离子化合物ZW
C.简单离子半径: Q->Y2->Z+
D.常温下,XW3Q为气态,且X、W、Q均满足8电子稳定结构
难度: 困难查看答案及解析
-
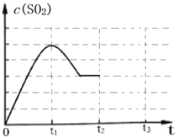
向废水中加入硫化物可以依次获得CuS、ZnS纳米粒子。常温下,H2S
Ka1=1.3×10-7,Ka2=7.1×10-15,溶液中平衡时相关离子浓度的关系如图,下列说法错误的是
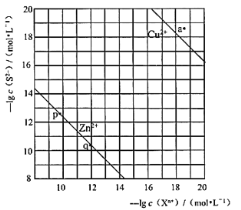
A.Ksp(CuS)的数量级为10-37
B.a点对应的CuS溶液为不饱和溶液
C.向p点的溶液中加入少量Na2S固体,溶液组成由p向q方向移动
D.H2S+Zn2+
ZnS + 2H+平衡常数很大,反应趋于完全
难度: 中等查看答案及解析
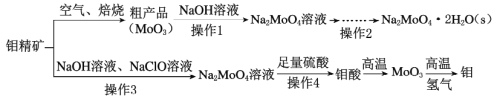
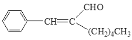 +H2O,有关数据如下表:
+H2O,有关数据如下表:
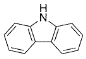 )的沸点比芴(
)的沸点比芴(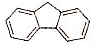 )高的主要原因是_______。
)高的主要原因是_______。
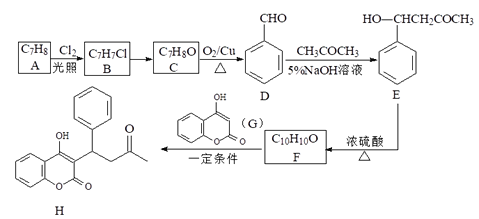
 (其他无机试剂自选),设计合成路线:____________。
(其他无机试剂自选),设计合成路线:____________。