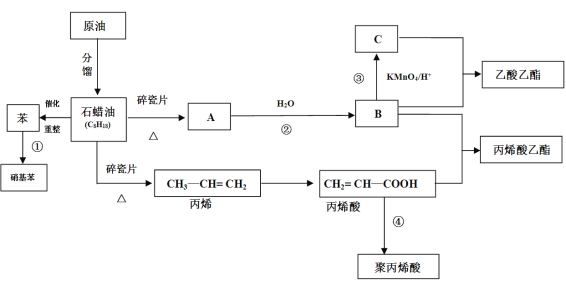
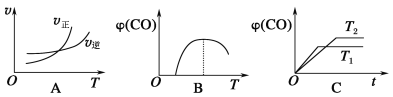
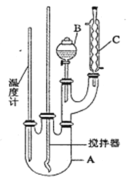
-
若乙酸分子中的羧基是16O,乙醇分子中的氧都是18O,二者在浓硫酸作用下发生反应,一段时间后,分子中含有18O的物质有
A. 1种 B. 2种 C. 3种 D. 4种
难度: 中等查看答案及解析
-
下列说法正确的是
A. 糖类、油脂、蛋白质均能发生水解
B. 氨基酸均只含有一个羧基和一个氨基
C. 植物油能使溴的四氯化碳溶液褪色
D. 聚乙烯、油脂、纤维素均为高分子化合物
难度: 中等查看答案及解析
-
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关反应的说法正确的是
A. 反应中MnO2是还原剂
B. 电池工作时,海水起导电作用,其中NaCl浓度保持不变
C. Ag为负极,电极反应为Ag-e-+Cl-=AgCl
D. 每生成1 mol Na2Mn5Ol0转移1mol电子
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是( )
选项
不纯物
除杂试剂
分离方法
A
CH4(C2H4)
酸性KMnO4溶液
洗气
B
苯(Br2)
NaOH溶液
过滤
C
C2H5OH(H2O)
新制生石灰
蒸馏
D
乙酸乙酯(乙酸)
饱和Na2CO3溶液
蒸馏
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.
Cl与
Cl得电子能力相同
难度: 简单查看答案及解析
-
下列金属的冶炼中,通过在高温下加入还原剂来完成的是( )
A.Na B.Fe C.Al D.Ag
难度: 简单查看答案及解析
-
下列变化中主要属于化学变化的有( )项
①风化 ②皂化 ③酯化 ④煤的气化 ⑤煤的液化 ⑥石油裂化 ⑦苯的硝化 ⑧盐析 ⑨石油分馏 ⑩焰色反应
A.5 B.6 C.7 D.8
难度: 简单查看答案及解析
-
青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是
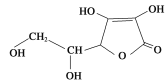
A.维生素C中含有3种官能团
B.维生素C分子式为C6H8O6
C.维生素C能使酸性高锰酸钾溶液褪色
D.维生素C在碱性溶液中能稳定存在
难度: 中等查看答案及解析
-
现有两个热化学方程式:下列说法中正确的是( )
(l)+H2(g)
(l)
>0 ①
(l)+2H2(g)
<0 ②
A.反应①②中都存在:ΔS>0
B.反应②高温时,可自发进行
C.在通常情况下,①②都能自发进行
D.反应①一定不能自发进行
难度: 简单查看答案及解析
-
下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是
A.分子式为C5H10的烯烃 B.甲苯的一氯代物
C.相对分子质量为74的一元醇 D.立方烷(
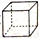 )的二硝基取代物
)的二硝基取代物难度: 困难查看答案及解析
-
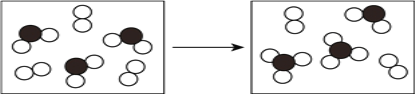
有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
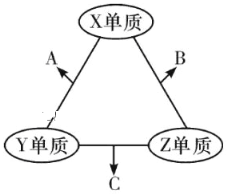
A.X与Z形成的某种化合物可用来杀菌消毒 B.C极易溶于B中,溶液呈碱性
C.Y与Z形成的二元化合物只含有极性键 D.A和C能发生氧化还原反应
难度: 困难查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
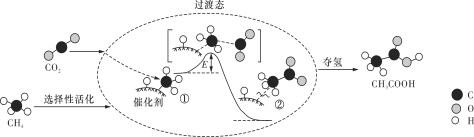
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
下图是2SO3(g)
2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
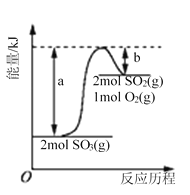
A.该化学反应过程中既有能量的吸收又有能量的释放
B.2SO3(g)
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C.1 mol SO2的能量比1 mol SO3的能量高
D.若某容器内有2 mol SO3充分反应,吸收(a-b) kJ热量
难度: 简单查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,r溶液为强电解质溶液,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是( )
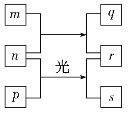
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
难度: 中等查看答案及解析
-
一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25。使混合气通过足量溴水,溴水增重8.4g,则混合气中的烃分别是( )
A.甲烷和乙烯 B.甲烷和丙烯
C.乙烷和乙烯 D.乙烷和丙烯
难度: 中等查看答案及解析
-
海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是( )
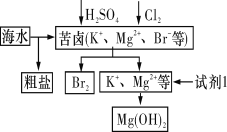
A.可用BaCl2溶液除去粗盐中的SO
B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2===2Cl-+Br2
C.试剂1可以选用石灰乳
D.工业上,通常电解氯化镁溶液来冶炼金属镁
难度: 中等查看答案及解析
-
合成导电高分子化合物PPV的反应为:
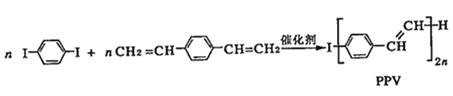 +(2n-1)HI
+(2n-1)HI下列说法正确的是( )
A.PPV 是聚苯乙烯 B.该反应为加聚反应
C.
属于芳香烃 D.1mol
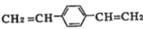 最多可与5molH2发生反应
最多可与5molH2发生反应难度: 简单查看答案及解析