-
下列反应中生成物总能量高于反应物总能量的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 中等查看答案及解析
-
化学与人类生活和社会可持续发展关系密切。下列措施正确的是
①将酒精和84消毒液混用,提高杀灭新冠病毒的效果;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 简单查看答案及解析
-
下列化学用语使用正确的是
A.S原子的结构示意图:
B.NH4Cl 的电子式:
C.甲烷的结构式: CH4 D.乙酸的结构简式:CH3COOH
难度: 简单查看答案及解析
-
下列不属于化石燃料的是
A.煤 B.石油 C.天然气 D.乙醇
难度: 简单查看答案及解析
-
下列各组物质互为同系物的是
A.12C和14C B.金刚石和石墨 C.C2H6和C3H8 D.CH3CH2OH和CH3OCH3
难度: 简单查看答案及解析
-
下列物质中既有离子键又有共价键的是
A.NaOH B.H2O C.K2O D.CaCl2
难度: 简单查看答案及解析
-
下列过程属于化学变化的是
A.光线照射胶体产生丁达尔效应 B.铝遇到冷的浓硝酸发生钝化
C.通过石油的分馏获取汽油 D.蛋白质溶液遇食盐水发生盐析
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L苯所含的碳碳双键数为3NA
B.常温常压下,1mol乙烯所含电子数为12NA
C.1mol金属钠在足量乙醇中完全反应转移的电子数为NA
D.在1L 1mol·L-1的乙酸溶液中含乙酸分子数为NA
难度: 简单查看答案及解析
-
某强酸性溶液中,下列离子能够大量共存的是
A.K+、
、Cl- B.Na+、K+、
C.Fe2+、 Cl-、
D.Ba2+、
、
难度: 简单查看答案及解析
-
表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:
+HNO3

+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
难度: 中等查看答案及解析
-
下列实验装置正确且能达到实验目的的是

A.用装置甲制取少量NH3 B.用装置乙验证SO2的还原性
C.用装置丙配制100 mL 0.10 mol·L-1的硫酸溶液 D.用装置丁分离水和乙醇
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
除去NaHCO3固体中混有的NH4HCO3
直接将固体加热
B
实验室收集NO2气体
用排水集气法收集
C
检验非金属性Cl>C
在Na2CO3溶液中加入足量HCl
D
检验某溶液中是否有
取该溶液于试管中,加入NaOH溶液后加热,用湿润的红色石蕊试纸检验
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
锌~空气燃料电池可用作电动车动力电源, 电池的电解质溶液为KOH溶液,电池总反应为2Zn + O2+ 4OH- + 2H2O = 2
。下列说法正确的是
A.锌极发生还原反应 B.电子从锌极经KOH溶液移向充空气的电极
C.锌极需定期更换 D.该电池是电能转化为化学能的装置
难度: 简单查看答案及解析
-
钢铁表面分别镀有下列几种金属。当镀层金属部分被破坏时,铁腐蚀最慢的是
A.Sn B.Zn C.Cu D.Ag
难度: 简单查看答案及解析
-
在500℃和催化剂存在的条件下,某固定容积的容器中发生放热反应2SO2(g)+O2(g) ⇌2SO3(g)。下列说法正确的是
A.若降低温度,可以加快反应速率 B.使用催化剂是为了加快反应速率
C.在上述条件下,SO2 能完全转化为SO3 D.达到平衡时SO2和SO3的浓度一定相等
难度: 简单查看答案及解析
-
下列四种烃分子的球棍模型说法正确的是( )
A.
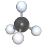 能使酸性高锰酸钾溶液褪色 B.
能使酸性高锰酸钾溶液褪色 B. 能与溴水发生取代反应
能与溴水发生取代反应C.
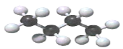 不存在同分异构体 D.
不存在同分异构体 D.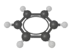 分子中所有原子共平面
分子中所有原子共平面难度: 中等查看答案及解析
-
下列物质属于高分子化合物的是
A.蔗糖 B.油脂 C.氨基酸 D.淀粉
难度: 简单查看答案及解析
-
下列有机化学方程式中属于加成反应的是
A.CH4+Cl2
CH3Cl+HCl B.CH4+2O2
CO2+H2O
C.CH2=CH2+HBr
CH3CH2Br D.
+Br2
+HBr
难度: 简单查看答案及解析
-
五种短周期元素的原子半径及主要化合价如表所示:
元素符号
X
Y
Z
R
T
原子半径(nm)
0.160
0.080
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
下列说法正确的是
A.离子半径:T2->X2+ B.单质与氢气化合的难易程度:Z>T
C.元素最高价氧化物对应水化物的碱性: R>X D.相同条件下,单质与稀硫酸反应的剧烈程度: Y> X
难度: 中等查看答案及解析
-
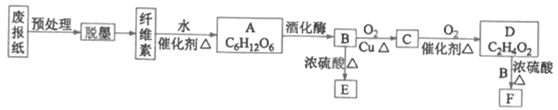
工业上冶炼钼的化学原理为:
①2MoS2+7O2
2MoO3+4SO2
②MoO3+2NH3·H2O=(NH4)2MoO4+H2O
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl
④H2MoO4
MoO3+H2O
⑤用还原剂将MoO3还原成金属钼。则下列说法中正确的是
A.MoS2煅烧产生的尾气可以直接排到空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
难度: 中等查看答案及解析