-
下列反应中,属于加成反应的是
A.乙烯与氢气反应生成乙烷 B.甲烷与氯气反应生成一氯甲烷
C.乙醇与氧气反应生成乙醛 D.乙酸与乙醇反应生成乙酸乙酯
难度: 简单查看答案及解析
-
《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。下列关于
说法正确的是
A.质子数为203 B.质量数与电子数之差为122
C.中子数为81 D.
和
互为同素异形体
难度: 简单查看答案及解析
-
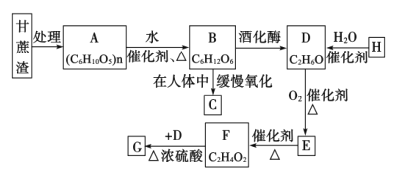
化学与生产生活密切相关,下列说法正确的是( )
A. 平昌冬奥会“北京8分钟”主创团队用石墨烯制作发热服饰,说明石墨烯是导热金属材料
B. “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油
C. “一带一路”被誉为现代丝绸之路”,丝绸属于合成纤维,主要含C、H、O、N元素
D. 聚乙烯
和聚氯乙烯
都是食品级塑料制品的主要成分
难度: 简单查看答案及解析
-
下列性质的比较,不能用元素周期律解释的是
A.原子半径:S>Cl
B.热稳定性:Na2CO3>NaHCO3
C.还原性:I﹣>Br﹣
D.酸性:H2SO4>H3PO4
难度: 中等查看答案及解析
-
下列叙述正确的是
A.欲配制1L1mol/L的NaCl溶液,可将58.5gNaCl溶于1L水中
B.可用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
C.实验室制取乙酸乙酯时药品的加入顺序依次为浓硫酸、乙醇、乙酸
D.充满Cl2和CH4的试管倒扣在盛有饱和NaCl溶液的水槽中,光照,试管内液面上升
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z的原子最外层电子数之和为5;W与Y同族;X是形成化合物种类最多的元素,W的单质为常见气体,其水溶液具有漂白性。下列说法正确的是
A.Y的最高正化合价为+7
B.元素X的氢化物中,各原子均满足8电子的稳定结构
C.Z的氧化物中阴阳离子个数比为1:2
D.W的单质与过量的铁反应产物为FeW2
难度: 简单查看答案及解析
-
下列解释事实的离子方程式书写正确的是
A.向氯化铁溶液中加入铁粉,颜色变浅:2Fe3++Fe=3Fe2+
B.向碳酸氢钠溶液中滴加稀盐酸,产生气体:
+2H+=CO2↑+H2O
C.向稀硝酸溶液加入少量锌粉:Zn+2H+=Zn2++H2↑
D.向氢氧化钡溶液中滴加稀硫酸,生成沉淀:Ba2++
=BaSO4↓
难度: 中等查看答案及解析
-
下列说法不正确的是
A.光导纤维的主要成分是SiO2
B.工业浓硝酸通常呈黄色
C.实验室可以用NaOH溶液处理SO2和NO2
D.Cl2具有很强的氧化性,在化学反应中只能做氧化剂
难度: 中等查看答案及解析
-
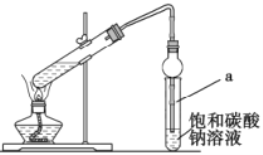
下列实验方案不能达到目的是
A.用萃取的方法分离煤油和汽油
B.用水鉴别苯、四氯化碳、乙醇三种无色液体
C.用如图装置验证Na和水反应是否为放热反应
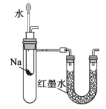
D.棉织品与丝织品可以用灼烧法进行鉴别
难度: 中等查看答案及解析
-
关于下列图示的说法中正确的是( )
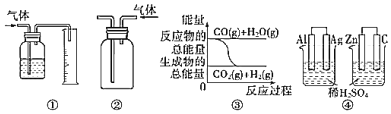
A.用图①所示装置测量气体的体积
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)是放热反应
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在强酸性或强碱性溶液中:HCO3-、SO42-、K+、Cl-
B.使酚酞呈红色的溶液:NH4+、Ba2+、OH-、Cl-
C.pH>7的溶液:K+、Na+、CH3COO-、I-
D.饱和氯水中:C1-、NO3-、Na+、SO32-
难度: 中等查看答案及解析
-
物质中杂质(括号内为杂质)的检验方法、除杂试剂或方法均正确的是
选项
物质及其杂质
检验方法
除杂
A
Cl2(HCl)
通入AgNO3溶液中
饱和食盐水
B
FeCl2溶液(FeCl3)
滴入KSCN溶液
通入过量氯气
C
食盐(I2)
滴入淀粉溶液
升华
D
乙烷(乙烯)
溴水
一定条件下通入氢气
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
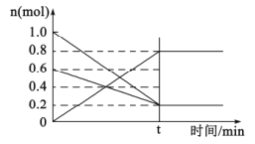
设NA表示阿伏加德罗常数,下列叙述正确的是
A.15g甲基(-CH3)中含有的电子数为9NA
B.标准状况下,2.24L辛烷中所含碳原子数为0.8NA
C.1.8gH2O与D2O的混合物中含有的质子数和电子数均为NA
D.—定条件下,密闭容器中2molSO2(g)与1molO2(g)充分反应,则容器中分子数为2NA
难度: 中等查看答案及解析
-
下列说法正确的的是
A.只含非金属元素的化合物一定是共价化合物
B.Na2CO3和CaCl2中化学键类型完全相同
C.含有共价键的物质不一定是共价化合物
D.溶于水能导电的化合物一定是电解质
难度: 中等查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(—种固体催化剂)合成NH3的原理示意图如图。下列说法不正确的是
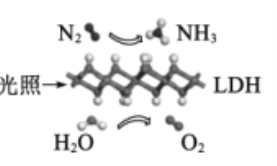
A.该过程将太阳能转化成为化学能
B.氧化剂与还原剂的物质的量之比为1:3
C.该过程中,涉及离子键和共价键的断裂与生成
D.原料气N2可通过分离液态空气获得
难度: 中等查看答案及解析
-
催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
A. CO2、H2、CH3OH、H2O的浓度一定相等
B. 该反应已经达到化学平衡状态
C. CO2和H2完全转化为CH3OH和H2O
D. CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零
难度: 中等查看答案及解析
-
下列实验的现象与对应结论均正确的是
选项
操作
现象
结论
A
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
B
向某溶液中逐滴加入盐酸
产生无色无味气体
此溶液中含有
或
C
向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无
D
先向某溶液中逐滴加入氯化钡溶液,再加稀硝酸
有白色沉淀产生,且沉淀不溶解
此溶液中一定含有
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
水热法制备直径为1-100nm的颗粒Y(化合物),反应原理为3Fe2++2
+O2+aOH-=Y+
+2H2O,下列说法中不正确的
A.a=4
B.将Y均匀分散到水中形成的体系具有丁达尔效应
C.Fe2+、
都是还原剂
D.每有3molFe2+参加反应,反应中转移的电子总数目为5NA
难度: 中等查看答案及解析