-
下列烷烃进行一氯取代反应后,只能生成两种不同的取代产物的是( )
A. (CH3)2CHCH2CH2CH3 B. (CH3CH2)2CH CH2CH3
C. (CH3)2CHCH(CH3)2 D. (CH3)3CCH2CH3
难度: 中等查看答案及解析
-
下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
难度: 简单查看答案及解析
-
瑞德西韦是抗击新型肺炎的明星潜力药。其由H、C、N、O、P五种元素组成。下列叙述错误的是
A.简单的离子半径:P3->N3->O2-
B.由H、N、O组成的化合物都是共价化合物
C.最简单的氢化物的热稳定性:H2O>NH3
D.最高价氧化物对应的水化物的酸性:HNO3>H3PO4
难度: 中等查看答案及解析
-
某小组对反应2X (g) + Y(g)⇌2Z(g)进行对照实验(见下表)。下列有关说法错误的是( )
实验序号
反应温度
c(X)mol/L
c(Y)mol/L
1
400℃
2
1
2
400℃
2
2
A.该反应为可逆反应 B.探究温度对反应速率的影响
C.探究浓度对反应速率的影响 D.实验2的反应速率较快
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.HClO的电子式为
B.Na2O2属于离子化合物,含有离子键,不含共价键
C.用电子式表示Na2O的形成过程为
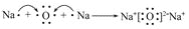
D.含6个质子和8个中子的碳元素的核素符号:12C
难度: 简单查看答案及解析
-
已知A、B、C、D为原子序数依次增大的短周期元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20,C单质能与无色无味液体m反应置换出B单质,D单质也能与m反应置换出A单质,A、B、C均能与D形成离子化合物,下列说法正确的是( )
A.原子半径大小:r(D)>r(C)>r(B)
B.气态氢化物稳定性:B>C
C.A、B分别与D形成的化合物的水溶液均显碱性
D.A与B形成的分子中,A和B原子均满足8电子稳定结构
难度: 中等查看答案及解析
-
下列有关电化学在生产、生活中的应用分析正确的是
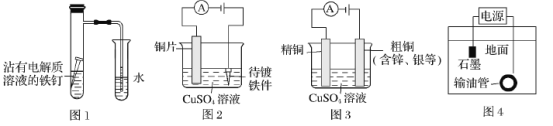
A.图1:铁钉发生析氢腐蚀 B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变 D.图4:将输油管与电源负极相连可以防止腐蚀
难度: 中等查看答案及解析
-
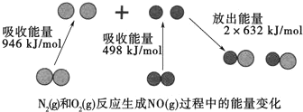
乙醇做为可再生能源比化石能源具有较大的优势,如图为乙醇燃料电池,该电池的总反应方程式为C2H5OH+3O2=2CO2+3H2O。下列关于该电池叙述错误的是

A.a极与用电器的正极相接 B.该装置将化学能转化为电能
C.质子(H+)由装置左侧向右侧移动 D.该装置的电解质溶液呈酸性
难度: 简单查看答案及解析
-
不同条件下,用O2氧化一定浓度的FeCl2溶液过程中所测的实验数据如图所示。下列分析或推测不合理的是
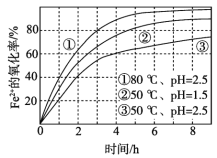
A. Fe2+的氧化率随时间延长而逐渐增大
B. 由②和③可知,pH越大,Fe2+氧化速率越快
C. 由①和③可知,温度越高,Fe2+氧化速率越快
D. 氧化过程的离子方程式为:4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O
难度: 中等查看答案及解析
-
下列有关有机物结构的叙述不正确的是( )
A.一氟一氯甲烷只有一种结构,可以证明甲烷是正四面体结构
B.构成乙烯分子的所有原子都在同一平面内,其分子中只含有极性键
C.邻二甲苯没有同分异构体表明苯的凯库勒结构式不准确
D.
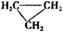 和CH3一CH=CH2互为同分异构体
和CH3一CH=CH2互为同分异构体难度: 中等查看答案及解析
-
关于下列图示的说法正确的是( )
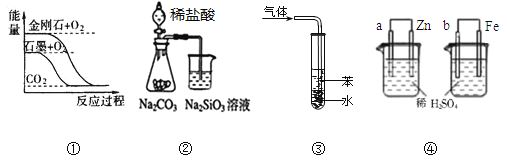
A.图①表示石墨转变为金刚石是吸热反应
B.图②所示实验可比较非金属性强弱:氯﹥碳﹥硅
C.图③吸收NH3并防倒吸
D.图④两装置中金属电极a、b都有气体产生,可判断金属活动性:a﹤b
难度: 中等查看答案及解析
-
烷烃
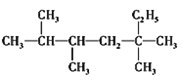 是单烯烃R和H2发生加成反应后的产物,则R可能的结构有
是单烯烃R和H2发生加成反应后的产物,则R可能的结构有A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
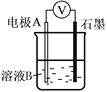
如图所示,有关化学反应和能量变化的说法正确的是( )
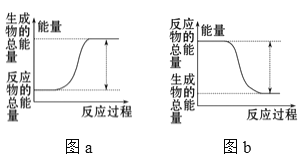
A.图a表示的是吸热反应的能量变化
B.图a一定需要加热才能发生,图b不加热也能发生
C.图b中反应物比生成物稳定
D.图b可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
难度: 中等查看答案及解析
-
一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s
0
2
4
6
8
n(SO3) / mol
0
0.8
1.4
1.8
1.8
下列说法正确的是( )
A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时
减小
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是( )
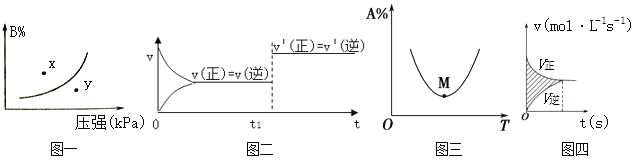
A. 图一表示反应:mA(s)+nB(g)⇌pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)⇌C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) ⇌ pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
难度: 困难查看答案及解析