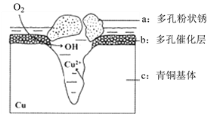
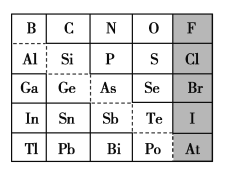
-
W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法不正确的是( )
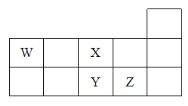
A.Z、Y、W的最高价氧化物的水化物的酸性依次减弱
B.Z、Y、X的原子半径依次减小,非金属性依次减弱
C.气态氢化物的稳定性:H2X>H2Y
D.W的位置是第二周期第ⅣA族
难度: 中等查看答案及解析
-
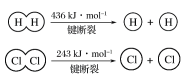
下列物质间的反应,其能量变化符合如图的是
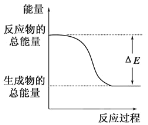
A.碳酸钙的分解 B.碳和水蒸气制取水煤气(CO、H2)
C.铁生锈 D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
难度: 简单查看答案及解析
-
在2A(g)+B(g)⇌3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列化学用语的书写,正确的是
A.氯原子的结构示意图:

B.6个质子8个中子的碳元素的核素符号:12C
C.氯化镁的电子式:
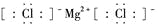
D.用电子式表示氯化氢的形成过程:
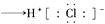
难度: 困难查看答案及解析
-
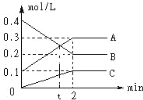
在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol
时间/min
n(N2)
n(H2)
n(NH3)
0
1.0
1.2
0
2
0.9
4
0.75
6
0.3
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
难度: 困难查看答案及解析
-
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
A.
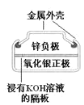 正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-
正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-B.
 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄C.
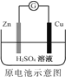 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加D.
 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降难度: 中等查看答案及解析
-
化合物
是一种新型锅炉水除氧剂,其结构式为
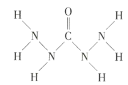 ,下列说法正确的是(其中
,下列说法正确的是(其中表示阿伏加德罗常数的值)( )
A.
分子中只含极性键,不含非极性键
B.
分子中的共用电子对数为11
C.
分子中所含键的数目为
D.
是共价化合物
难度: 困难查看答案及解析