-
根据下列电子排布式判断,处于激发态的原子是
A. 1s22s22p6 B. 1s22s22p63s1 C. 1s22s23s1 D. [Ar]3d14s2
难度: 简单查看答案及解析
-
下列说法中错误的是:
A.SO2、SO3都是极性分子 B.在NH4+和[Cu(NH3)4]2+中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
难度: 中等查看答案及解析
-
下列各原子或离子的电子排布式错误的是( )
A. K+1s22s22p63s23p6
B. F 1s22s22p5
C. S2-1s22s22p63s23p4
D. Ar 1s22s22p63s23p6
难度: 简单查看答案及解析
-
下列对一些实验事实的理论解释正确的是
选项
实验事实
理论解释
A
碘单质在 CCl4 中溶解度比在水中大
CCl4 和 I2 都是非极性分子, 而 H2O 是极性分子
B
CO2 为直线形分子
CO2 分子中 C═O 是极性键
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
HF 的沸点高于 HCl
HF 的相对分子质量小于 HCl
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列叙述正确的是
A.离子晶体中,只存在离子健,不可能存在其它化学键
B.可燃冰中甲烷分子与水分子之间存在氢键
C.Na2O2、NaHSO4晶体中的阴、阳离子个数比均为1 2
D.晶体熔点:金刚石>食盐>冰>干冰
难度: 中等查看答案及解析
-
下列说法正确的是
A. 3p2表示3p能级有两个轨道
B. 同一原子中,1s、2s、3s电子的能量逐渐减小
C. 每个周期中最后一种元素的第一电离能最大
D. 短周期中,电负性(稀有气体未计)最大的元素是Na
难度: 中等查看答案及解析
-
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2、②SiO2、③石墨、④金刚石、⑤NaCl、⑥白磷中,含有以上其中两种作用力的是( )
A.①②③ B.①③⑥ C.②④⑥ D.①②③⑥
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.离子晶体中一定不含分子 B.分子晶体中一定不含离子
C.金属离子一定满足最外层电子数为2或8 D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 简单查看答案及解析
-
下列分子中,所有原子不是处于同一平面的是
A. H2O B. CH4 C. C2H4 D.
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B.由于氢键的作用,H2O的稳定性强于H2S
C.在核电荷数为26的元素原子核外价电子排布图为
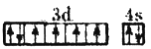
D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
难度: 中等查看答案及解析
-
固体熔化时必须破坏非极性共价键的是 ( )
A.冰 B.晶体硅
C.溴单质 D.二氧化硅
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.铬原子的电子排布式:1s22s22p63s23p63d44s2
B.Na、Mg、Al的第一电离能逐渐增大
C.碳原子的轨道表示式:
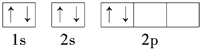
D.N、O、F的电负性逐渐增大
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是 ( )
A.35Cl和37Cl的原子结构示意图均为
B.HC1O的电子式:
C.CO2的比例模型:
D.HCl的电子式:
难度: 简单查看答案及解析
-
下列物质的沸点变化顺序正确的是
A. CH4>SiH4>GeH4>SnH4
B. NH3<PH3<AsH3<SbH3
C. H2O>H2S>H2Se>H2Te
D. HCl<HBr<HI<HF
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是( )
A.石英的分子式:SiO2
B.NH4Cl 的电子式:
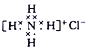
C.Cr原子的基态简化电子排布式为[Ar]3d54s1
D.S原子的外围电子排布图为

难度: 简单查看答案及解析
-
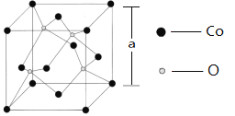
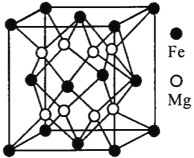
某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( )
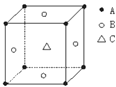
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
难度: 简单查看答案及解析
-
下列分子中含有“手性碳原子”的是( )
A. CBr2F2 B. CH3CH2CH2OH C. CH3CH2CH3 D. CH3CH(NO2)COOH
难度: 简单查看答案及解析
-
下列各离子的电子排布式错误的是( )
A.Na+ 1s22s22p6 B.F- 1s22s22p6 C.N3+ 1s22s22p6 D.O2- 1s22s22p6
难度: 中等查看答案及解析
-
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素的下列叙述:
①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A<B;⑤A 的正价与B的负价绝对值一定相等;⑥A的电负性小于B的电负性;⑦A的第一电离能大于B的第一电离能。其中正确的组合是( )
A.③④⑥ B.①②⑦ C.③⑤ D.③④⑤⑥⑦
难度: 中等查看答案及解析
-
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
难度: 简单查看答案及解析