-
下列有关物质用途的叙述错误的是
A.SO2可用于杀菌消毒,是一种食品添加剂
B.液氨常用作制冷剂,是因为氨气液化时要吸收大量的热
C.硅单质具有良好的半导体性能,可制成计算机的芯片
D.硫酸铵、碳酸氢铵等铵盐是农业上常用的化肥
难度: 简单查看答案及解析
-
下列关于物质工业制法的叙述错误的是
A.陶瓷、玻璃、水泥的生产中均用到了石灰石
B.工业制备高纯硅涉及的主要反应中,所有的反应均为氧化还原反应
C.工业制硫酸过程中,常用98.3%的浓硫酸吸收SO3
D.氨催化氧化是工业制硝酸的基础
难度: 中等查看答案及解析
-
下列叙述中正确的个数为
①通过豆科植物的根瘤菌将氮气转化为含氮化合物,是自然固氮的途径之一
②硝酸见光分解,所以硝酸一般盛放在棕色试剂瓶中
③CO、NO、NO2都是大气污染气体,在空气中能稳定存在
④常温下,可以用铁制容器盛装浓硝酸,这是因为铁在常温下与浓硝酸不反应
⑤浓硫酸与蔗糖反应时,蔗糖变黑,同时膨胀,体现浓硫酸的吸水性和强氧化性
⑥可以用CS2清洗残留硫粉的试管
A.4个 B.3个 C.2个 D.1个
难度: 简单查看答案及解析
-
下列各物质中,物质之间通过一步反应就能实现如图转化关系的是选项abc转化关系
选项
a
b
c
转化关系
A
Fe
Fe2S3
FeCl3
B
N2
NO2
HNO3
C
Si
SiO2
H2SiO3
D
S
SO2
H2SO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A.工业制硫酸的反应中,若通入128 g SO2,生成SO3的分子数目为2NA
B.2 mol Na2S分子中含有S原子的数目为2NA
C.标准状况下,6.72 L NH3溶于水后,溶液中NH3·H2O和
数目之和为0.3NA
D.Zn与浓硫酸充分反应后,收集到气体0.5 mol,电子转移的数目为NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.NaOH溶液需要用胶塞试剂瓶盛装:SiO2+2Na++2OH-=Na2SiO3+H2O
B.铝与浓硫酸反应:2Al+6H+=2Al3++3H2↑
C.检验
涉及的反应:
+OH-
NH3·H2O
D.硫代硫酸钠与稀硫酸反应:
+2H+=S↓+SO2↑+H2O
难度: 简单查看答案及解析
-
下列叙述正确的是
A.浓硫酸稀释、酸碱中和反应,均为放热反应
B.SiO2既能与NaOH溶液反应,又能与HF溶液反应,所以SiO2是两性氧化物
C.向某溶液中先加足量稀盐酸无明显现象,再加BaCl2溶液,若产生白色沉淀,则该溶液中一定含有
D.某红棕色气体能使湿润的淀粉碘化钾试纸变蓝,说明该气体一定是NO2
难度: 中等查看答案及解析
-
根据所给的实验装置,下列有关实验的相关叙述正确的是
选项
实验装置
相关叙述
A
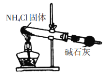
实验室可以用该装置和药品制取氨气
B
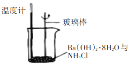
反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应
C
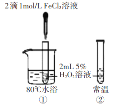
①中反应比②中快,说明温度升高可以加快反应速率
D
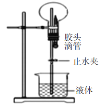
只有氨气等极易溶于水的气体才能利用该装置形成喷泉
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
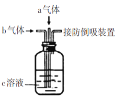
选项
a气体
b气体
c溶液
实验现象
A
Cl2(1mol)
SO2(1mol)
品红溶液
溶液颜色变浅或褪色
B
H2S
SO2
水
产生淡黄色沉淀
C
SO2
NO2
BaCl2溶液
产生白色沉淀
D
NO
O2
滴加少量酚酞的NaOH溶液
溶液颜色变浅或褪色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
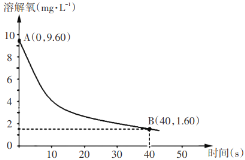
某温度下,在2L容器中发生反应,A、B、C物质的量随时间变化的曲线如图所示。下列叙述中正确的是
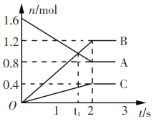
A.该反应的化学方程式为2A
B+3C
B.反应开始至2s时,A的平均反应速率为0.4 mol(/L·s)
C.t1时刻,该反应达到化学平衡状态
D.反应开始至1s时,生成C的物质的量大于0.2 mol
难度: 简单查看答案及解析
-
对于反应C(s)+H2O(g)
CO(g)+H2(g),当其他条件不变时,下列措施中,可以增大化学反应速率的是
A.增加C的质量 B.恒压条件下充入氦气 C.降低温度 D.压缩容器体积
难度: 简单查看答案及解析
-
一定条件下,体积固定的密闭容器中,发生反应H2(g)+I2(g)
2HI(g)。下列情况可以说明该反应一定达到化学平衡的是
A.断裂1 mol H-H键,同时生成2 mol H-I键 B.容器内压强保持不变
C.容器内气体颜色保持不变 D.容器内H2、I2和HI的物质的量之比为1:1:2
难度: 简单查看答案及解析
-
下图为H2(g)和O2(g)生成H2O(g)过程中的能量变化。下列叙述中正确的是
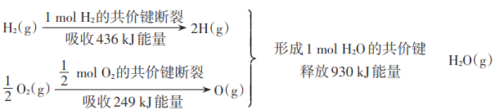
A.该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol O(g)原子结合成O2(g)时,吸收498kJ能量
C.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(g)时,放热245kJ
D.1 mol H2(g)和0.5 mol O2(g)反应生成1 mol H2O(l)时,释放的热量小于245kJ
难度: 简单查看答案及解析
-
下列说法中正确的是
A.化学反应中能量变化的大小与反应物的质量多少无关
B.锌锰干电池中,锌筒作正极
C.蓄电池充电时发生氧化还原反应
D.合成氨的生产在温度较低时,氨的产率较高,所以合成氨工业中应尽可能选择低温进行反应
难度: 简单查看答案及解析
-
下列有关图像的结论正确的是
图像
结论
A
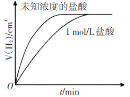
相同质量锌粉分别与1 mol/L盐酸及相同体积未知浓度的盐酸反应,未知浓度盐酸的浓度低于1 mol/L
B
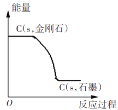
一定条件下,金刚石转化为石墨要释放能量,金刚石要比石墨稳定
C
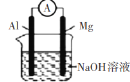
该装置为化学能转化为电能的装置,且Mg作负极
D
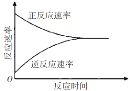
一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化曲线如图,反应开始时刻生成物的浓度不为0
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
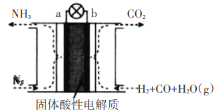
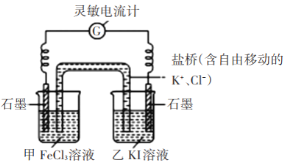
电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,交换膜分别是只允许阴阳离子通过的阴阳离子交换膜)。下列叙述中错误的是
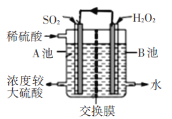
A.该交换膜为阳离子交换膜
B.若11.2 L(标准状况)SO2参与反应,则A池中增加2 mol H+
C.B池中的反应为H2O2+2e-+2H+=2H2O
D.导线上箭头方向表示电流方向
难度: 中等查看答案及解析
-
一个容积固定的5 L反应器中,有一可左右滑动的密封隔板,左侧进行如下可逆反应:2SO2(g)+O2(g)
2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
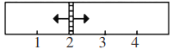
A.若左侧开始反应时v正>v逆,则5>x>1.75
B.若左侧开始反应时x=1.75,则起始时v正=v逆
C.若左侧开始反应时x=2,则达到平衡时混合气体中SO2所占的体积分数为25%
D.若左侧开始反应时x=1.65,则达到平衡时SO3的转化率为10%
难度: 困难查看答案及解析
-
15.3 g Mg-Al合金(无其他成分),加入到500 mL稀硝酸中,恰好完全反应后,共收集到标准状况下的NO气体11.2 L,向所得溶液中加入4 mol/L NaOH溶液400 mL,得到白色沉淀。下列叙述中正确的是
A.合金中,m(Mg):m(Al)=1:1
B.原稀硝酸的物质的量浓度与NaOH溶液相同
C.白色沉淀的成分为Mg(OH)2
D.过滤后,向白色沉淀中加入原稀硝酸250 mL,可将沉淀全部溶解
难度: 中等查看答案及解析
-
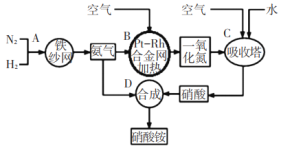
为落实“五水共治”,某工厂拟综合处理含
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

已知:1 mol CO和1 mol CH3OH分别完全燃烧生成CO2(g)和H2O(l),放出的热量为283.0kJ和726.5kJ。下列说法错误的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.气体X在流程中体现还原性
C.相同质量的CO和CH3OH完全燃烧,后者放出的热量多
D.处理含
废水时,发生反应的离子方程式为:
+
=N2↑+2H2O
难度: 中等查看答案及解析
-
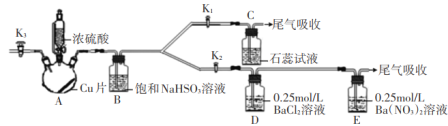
某无色溶液中可能含有H+、
、K+、Mg2+、Fe3+、Al3+、Cl-、
、
、
中的几种离子,且几种阴离子浓度相同(不考虑水的电离)。取三份该溶液于三支试管中,每份10 mL,进行如下操作:
①向试管1中滴加足量的BaCl2溶液,过滤后得到沉淀0.03 mol,向滤液中滴加AgNO3溶液有白色沉淀生成。
②向试管2中滴加一定浓度的NaOH溶液,产生沉淀的物质的量与NaOH溶液体积关系如图所示。
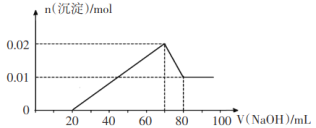
③向试管3中加入足量铜粉,铜粉溶解并产生无色气体,该气体在试管口处变为红棕色。
则下列说法中正确的是
A.该溶液中一定存在H+、K+、Mg2+、Al3+、Cl-、
、
B.该溶液中c(K+)一定为2 mol/L
C.试管2中滴加的NaOH溶液浓度一定为1 mol/L
D.试管3中溶解的铜粉质量一定为0.72 g
难度: 中等查看答案及解析