-
下列说法不正确的是( )
A. 钢铁的吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e-=Fe2+
B. 钢铁发生吸氧腐蚀,正极的电极反应为:O2+4e-+2H2O=4OH-
C. 破损后的镀锌铁板比镀锡铁板更耐腐蚀
D. 用牺牲阳极的阴极保护法保护钢铁,钢铁作原电池的负极
难度: 简单查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
难度: 中等查看答案及解析
-
相同物质的量浓度的NaX、NaY、NaZ三种盐溶液的pH分别为7、8、9,则相同物质的量浓度的HX、HY、HZ的酸性强弱顺序为 ( )
A.HX、HY、HZ B.HZ、HY、HX C.HX、HZ、HY D.HZ、HY、HX
难度: 中等查看答案及解析
-
化学与科学、技术、社会和环境密切相关.下列有关说法中错误的是( )
A.对废旧电池进行回收处理,主要是为了环境保护和变废为宝
B.用电解水的方法制取大量H2,可以缓解能源不足的问题
C.大力开发和应用氢能源有利于实现“低碳经济”
D.工业上,不能采用电解NaCl溶液的方法制取金属钠
难度: 中等查看答案及解析
-
下列反应中,生成物总能量高于反应物总能量的是( )
A.乙醇燃烧 B.氧化钙溶于水
C.Ba(OH)2·8H2O和NH4Cl固体反应 D.锌粉和稀硫酸反应
难度: 中等查看答案及解析
-
下列物质中,属于强电解质的是( )
A.CO2 B.NaOH溶液 C.AgCl D.NH3·H2O
难度: 中等查看答案及解析
-
在某无色透明的酸性溶液中,能够大量共存的离子组是( )
A.K+、Na+、MnO
、NO
B.Ba2+、K+、CH3COO-、Cl-
C.Al3+、Ba2+、HCO
、NO
D.NH
、Mg2+、K+、SO
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
D.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
难度: 中等查看答案及解析
-
100mL2mol/L盐酸与足量锌粒反应,能加快该反应速率又不影响生成氢气的量的物质是( )
A.6mol/L盐酸 B.醋酸钠固体 C.金属钠 D.硫酸铜溶液
难度: 中等查看答案及解析
-
常温下,下列溶液中氢离子浓度最小的是( )
A.pH=0的NaHSO4溶液 B.0.04mol·L-1硫酸
C.pH=3醋酸溶液 D.0.5mol·L-1盐酸
难度: 中等查看答案及解析
-
25℃时,水的电离可达到平衡:H2O
H++OH- △H>0,下列叙述正确的是
A.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 简单查看答案及解析
-
铅蓄电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)
2PbSO4(s)+2H2O(l)。下列说法正确的是( )
A.放电时Pb为正极,发生还原反应
B.放电时电解质溶液中的H+向负极移动
C.充电时阳极的电极反应为:PbSO4(s)-2e-=Pb(s)+SO
(aq)
D.充电时阳极附近电解质溶液的pH逐渐减小
难度: 中等查看答案及解析
-
向0.lmol/LCH3COOH溶液中加入少量CH3COONa晶体时,会引起( )
A.溶液的pH增大 B.CH3COOH电离程度增大
C.溶液的导电能力减弱 D.溶液中c(OH-)减小
难度: 简单查看答案及解析
-
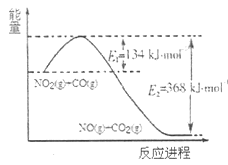
已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
H2O(l)=H2O(g) ΔH=+44kJ/mol
下列说法中,不正确的是( )
A.H2的燃烧热为285.8kJ/mol
B.2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
C.1molH2完全燃烧生成气态水放出的热量等于285.8kJ
D.形成1molH2O的化学键释放的总能量大于断裂1molH2和0.5molO2的化学键所吸收的总能量
难度: 中等查看答案及解析
-
在一定温度下,可逆反应
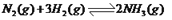 达到平衡的标志是
达到平衡的标志是A.
生成的速率和
分解的速率相等
B.
、
、
的浓度相等
C.单位时间内生成
,同时生成
D.
、
、
的分子数之比为1:3:2
难度: 简单查看答案及解析
-
下列有关事实,与水解反应无关的是
A. 醋酸钠溶液中,
B. 实验室保存
溶液时常加入Fe粉
C. 加热蒸干氯化铁溶液,不能得到氯化铁晶体
D. 用
和大量水反应,同时加热制备
难度: 简单查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是( )
A.
B.

C.

D.

难度: 中等查看答案及解析
-
A、B两种酸溶液pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
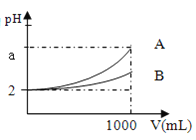
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则B为强酸,A为弱酸B
C.原酸溶液的浓度c(A)>c(B)
D.若a<5,则A、B都是弱酸
难度: 中等查看答案及解析
-
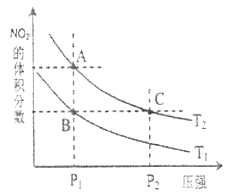
一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g)
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是
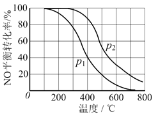
A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
难度: 中等查看答案及解析
-
已知:NaHSO3溶液呈酸性。常温下,将0.1mol/L亚硫酸(忽略H2SO3的分解)与0.1mol/LNaOH溶液等体积混合,下列关于该混合溶液说法不正确的是( )
A.c(Na+)>c(HSO
)>c(H2SO3)>c(SO
)
B.c(Na+)=c(HSO
)+c(SO
)+c(H2SO3)
C.c(HSO
)+c(H2SO3)+c(SO
)=0.05mol/L
D.c(Na+)+c(H+)>c(HSO
)+c(SO
)+c(OH-)
难度: 简单查看答案及解析
-
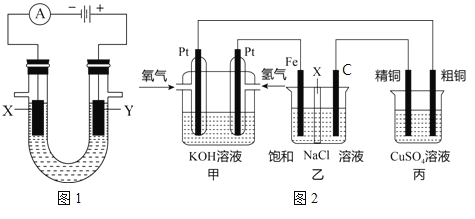
关于图中各装置的叙述不正确的是
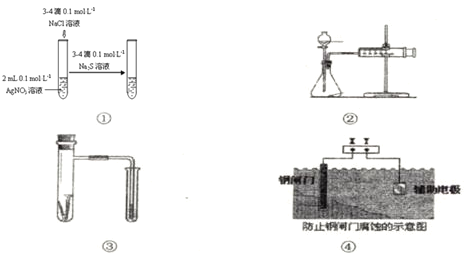
A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
B.装置②能测量锌与硫酸的反应速率
C.装置③能验证铁的吸氧腐蚀
D.装置④的X电极是负极,则能验证外接电源的阴极保护法
难度: 中等查看答案及解析
-
常温下,0.1 mol/L某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是 ( )
A.该溶液中水电离出的c(H+)=1×10-10mol/L
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol/L
C.该溶液与0.05 mol/LNaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
难度: 中等查看答案及解析
-
关于下列事实的解释,其原理表示不正确的是
A.常温下,测得
氨水的pH为11:
B.将
通入水中,所得水溶液呈酸性:
C.用
、
进行氢氧燃料电池实验,产生电流:
D.恒温恒容时,
平衡体系中,通人
,平衡正向移动:通入
后,体系中的
值小于平衡常数K
难度: 中等查看答案及解析
-
室温下,一元碱A与0.01mol/L一元强酸等体积混合后所得溶液的pH为7。下列说法正确的是( )
①若A为强碱,其溶液的物质的量浓度等于0.01mol/L
②若A为弱碱,其溶液的物质的量浓度大于0.01mol/L
③反应前,A溶液中c(OH-)一定是0.01mol/L
④反应后,混合溶液中阴离子的总浓度大于阳离子的总浓度
A.③④ B.①② C.①②③ D.①②③④
难度: 中等查看答案及解析
-
对下列图像的描述正确的是( )
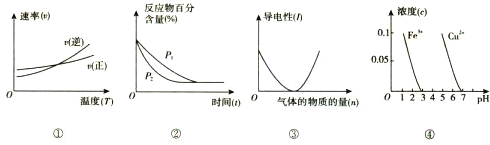
A. 根据图①可判断反应A2(g)+3B2(g)
2AB3(g)的△H>0
B. 图②可表示压强(P)对反应 2A(g)+2B(g)
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通人氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
难度: 中等查看答案及解析