-
下列措施能使Kw增大的是( )
A.温度不变向水中加入NaOH B.温度不变向水中加入H2SO4
C.温度不变向水中加入NaCl固体 D.加热升温
难度: 简单查看答案及解析
-
下列物质的水溶液,由于水解而呈酸性的是
A.NaHSO4 B.Na2CO3 C.HCl D.CuC12
难度: 中等查看答案及解析
-
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A.使用滴定管时,滴定管必须用待装液润洗2~3次
B.滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高
C.用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸
D.稀释浓硫酸时,将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌
难度: 中等查看答案及解析
-
下列各组物质中,都是强电解质的是( )
A.HBr、HCl、BaSO4
B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2O
D.HClO、NaF、Ba(OH)2
难度: 中等查看答案及解析
-
同温时,pH相等的盐酸溶液和醋酸溶液都稀释相同的倍数后,pH的大小关系是
A.盐酸>醋酸 B.醋酸>盐酸 C.盐酸=醋 D.无法判断
难度: 简单查看答案及解析
-
下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液
③检查滴定管是否漏水 ④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④
C.⑤②③①④ D.②①③⑤④
难度: 简单查看答案及解析
-
下列措施对增大反应速率明显有效的是( )
A. Na与水反应时增大水的用量
B. Fe与稀硫酸反应制取H2时,改用浓硫酸
C. 在K2SO4与BaCl2两溶液反应时,增大反应容器体积
D. Al在氧气中燃烧生成Al2O3,将Al片改成Al粉
难度: 简单查看答案及解析
-
物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX,HZ, HY B.HX,HY,HZ C.HZ,HY,HX D.HY,HZ,HX
难度: 简单查看答案及解析
-
下列关于吸热反应和放热反应的说法正确的是( )
A.需加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生
C.当ΔH<0时表明反应为吸热反应
D.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应
难度: 简单查看答案及解析
-
已知2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
A.+519.4kJ·mol-1 B.+259.7kJ·mol-1
C.-259.7kJ·mol-1 D.-519.4kJ·mol-1
难度: 简单查看答案及解析
-
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g)
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
难度: 简单查看答案及解析
-
符合图1、图2的反应是( )
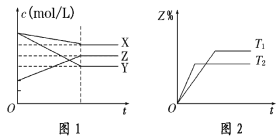
A.X(g)+3Y(g)
2Z(g) ΔH>0 B.X(g)+3Y(g)
2Z(g) ΔH<0
C.X(g)+2Y(g)
3Z(g) ΔH<0 D.X(g)+3Y(g)
4Z(g) ΔH<0
难度: 简单查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
难度: 中等查看答案及解析
-
下列反应过程中,ΔH>0且ΔS>0的是
A.NH3(g)+HCl(g)
NH4Cl(s)
B.CaCO3(s)
CaO(s)+CO2(g)
C.4Al(s)+3O2(g)
2Al2O3(s)
D.HCl(aq)+NaOH(aq)
NaCl(aq)+H2O(l)
难度: 中等查看答案及解析
-
下列溶液中导电性最强的是
A. 1L0.1mol/L醋酸 B. 0.1L 0.1mol/L H2SO4溶液
C. 0.5L 0.1mol/L盐酸 D. 2L 0.1mol/L H2SO3溶液
难度: 简单查看答案及解析
-
在含有酚酞的0.1 mol/L氨水中加入少量的NH4Cl晶体,则溶液颜色( )
A.变蓝色 B.变深 C.变浅 D.不变
难度: 简单查看答案及解析
-
下表是常温下某些一元弱酸的电离常数:
弱酸
HCN
HF
CH3COOH
HNO2
电离常数
6.2×10-10
6.8×10-4
1.8×10-5
6.4×10-6
则0.1 mol/L的下列溶液中,c(H+)最大的是
A. HCN B. HF C. CH3COOH D. HNO2
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.在任何条件下,纯水的pH都等于7
B.在任何条件下,纯水都呈中性
C.在95 ℃时,纯水的pH大于7
D.在95 ℃时,纯水中H+的物质的量浓度小于10-7 mol/L
难度: 简单查看答案及解析
-
两种不同浓度的NaOH溶液,c(H+)分别为1×10-14 mol/L 和1×10-10 mol/L。将此两溶液等体积混合后,所得溶液中的c(H+)是( )
A.1×(10-14+10-10) mol/L B.
mol/L
C.2×10-10 mol/L D.2×10-14 mol/L
难度: 简单查看答案及解析
-
某学生用碱式滴定管量取0.1 mol/L的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
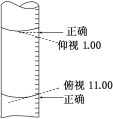
A.大于10.00 mL B.小于10.00 mL
C.等于10.00 mL D.等于11.00 mL
难度: 简单查看答案及解析
-
下列有关酸碱中和滴定的操作会引起误差的是( )
A.酸碱中和滴定时,在锥形瓶中准确地加入一定体积的待测液和滴入2~3滴指示剂后,为了便于观察现象而加入了适量的蒸馏水
B.酸碱中和滴定时,使用经过蒸馏水洗净但未干燥的锥形瓶装待测液
C.酸碱中和滴定时,使用经过蒸馏水洗净但留有水珠的滴定管直接装标准液
D.用NaOH标准溶液滴定未知浓度的稀盐酸时,选用酚酞作指示剂,实验时不小心多加入了一滴指示剂
难度: 简单查看答案及解析
-
常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是( )
A.11∶1 B.9∶1 C.1∶11 D.1∶9
难度: 简单查看答案及解析
-
用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=8。则此溶液的实际pH( )
A.大于8 B.小于8 C.等于8 D.小于7
难度: 简单查看答案及解析
-
关于盐类水解的实质,下列叙述正确的是( )
A.盐的电离平衡被破坏
B.水的电离平衡被破坏
C.没有中和反应发生
D.溶液的pH一定变大
难度: 中等查看答案及解析
-
下列各物质常温下发生水解,对应的离子方程式正确的是
A.Na2CO3:CO32-+2H2O
H2O+CO2↑+2OH-
B.NH4Cl:NH4++H2O
NH3·H2O+OH-
C.CuSO4:Cu2++2H2O
Cu(OH)2+2H+
D.NaF:F-+H2O=HF+OH-
难度: 简单查看答案及解析