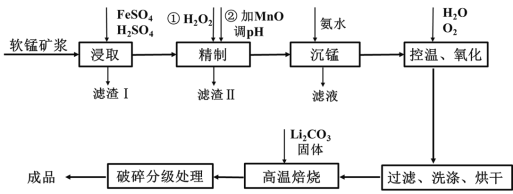
-
化学与生产、生活及社会发展密切相关。下列说法正确的是
A.植物油长期露置在空气中会因氧化反应而变质
B.碳纤维和制医用口罩的聚丙烯纤维都是有机高分子化合物
C.利用维生素C的氧化性,可防止鲜榨苹果汁变黄
D.过氧化氢、乙醇、过氧乙酸等均可将病毒氧化而达到消毒目的
难度: 中等查看答案及解析
-
使用化学药品必须注意安全,下列药品对应的安全标识不正确的是
A
B
C
D

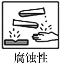


硝酸钾、氯酸钾
苛性钠、浓硫酸
四氯化碳、酒精
白磷、苯
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
、·CH3、
都是重要的有机反应中间体,有关它们的说法正确的是
A.·CH3中的碳原子杂化方式为sp2 B.
空间构型为正四面体
C.
中的键角大于NH3 D.
与OH-形成的化合物中含有离子键
难度: 中等查看答案及解析
-
南开大学的周其林院士及其团队凭借“高效手性螺环催化剂”的发现,获得了2019年度国家自然科学奖一等奖。一种手性螺环分子的结构简式如图所示。下列关于该有机物说法错误的是
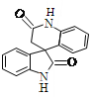
A.分子式为C16H12N2O2
B.分子中除氢原子之外的所有原子可能共平面
C.分子中只有一个手性碳原子
D.在酸性条件下能水解,且水解产物有8种化学环境不同的氢原子
难度: 中等查看答案及解析
-
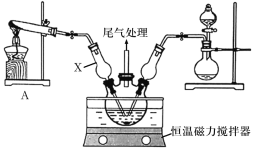
铁粉具有平肝镇心、消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
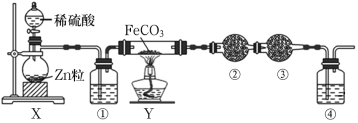
A.在锌粒中加入几粒硫酸铜晶体可能加快H2的生成
B.装置②、③中的药品分别是无水硫酸铜、氯化钙
C.装置①、④中药品为浓H2SO4
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
难度: 中等查看答案及解析
-
氮氧化铝(AlON)是新型透明高硬度防弹铝材料,属于共价晶体,主要用于装甲车辆防弹窗户、战场光学设备的透镜、望远镜穹顶以及覆盖于导弹传感器顶部的透明圆窗等。
下列描述错误的是
A.基态铝原子的价电子排布式为3s23p1 B.制备AlON的原料N2中N原子采取sp1杂化
C.AlON和水晶的化学键类型相同 D.AlON的熔点比AlCl3的熔点高
难度: 中等查看答案及解析
-
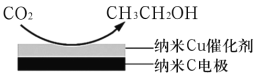
最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
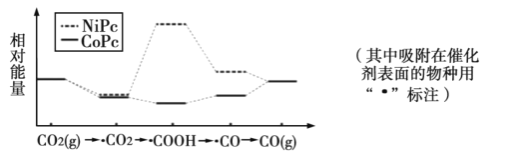
A.•CO2经还原反应得到•COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
难度: 中等查看答案及解析
-
光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是
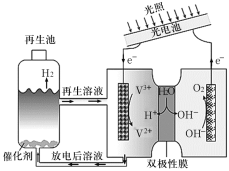
A.该装置中的能量转化形式:光能→电能→化学能
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应:2V2+ +2H2O
2V3+ +2OH-+ H2↑
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,Z原子2p轨道上有3个未成对电子,甲、乙、丙、丁、戊是这四种元素的两种或三种形成的化合物,75%的甲溶液常用于消毒,戊是Z和X组成的10电子分子,常温下己溶液显中性,它们有如下转化关系(反应条件已略去):
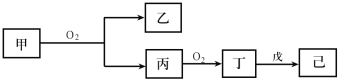
则下列说法中错误的是
A.四种元素原子半径由大到小的顺序为:Y>Z>W>X
B.可以用酸性KMnO4溶液鉴别甲和丙
C.己溶于水后促进了水的电离
D.W的氢化物不一定比Y的稳定
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
I3—溶液中存在平衡:
I3—
I2+I-
B
在Ca(ClO)2溶液中通入SO2气体,有沉淀生成
酸性:H2SO3>HClO
C
向淀粉碘化钾溶液中通入过量氯气,溶液由无色变为蓝色,后蓝色褪去
氯气具有强氧化性和漂白性
D
在植物油中滴几滴酸性高锰酸钾溶液,振荡,溶液褪色
植物油含有酯基
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是
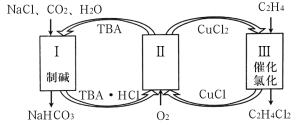
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.理论上每生成1mol NaHCO3,可得到1mol C2H4Cl2
D.过程Ⅲ中的反应是C2H4+2CuCl2
C2H4Cl2+2CuCl
难度: 困难查看答案及解析
-
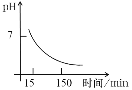
25℃时,向50mL浓度均为l.0mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知:25℃时,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是
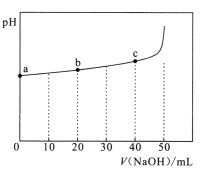
A.a点溶液中,c(H+)约为
B.b点溶液中,
C.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大
D.从a到c的过程中,溶液中
不变
难度: 中等查看答案及解析
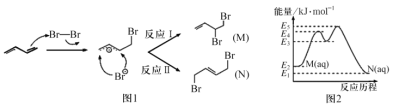
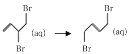 ∆H=-(E2-E1)kJ‧mol-1
∆H=-(E2-E1)kJ‧mol-1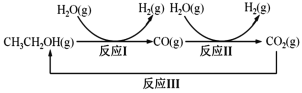
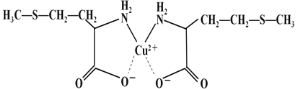
 。则由n(n>1)个
。则由n(n>1)个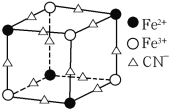
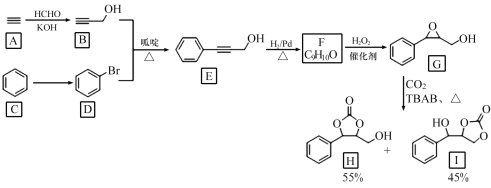
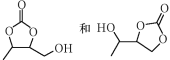 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。