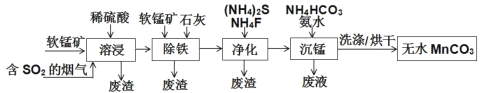
-
2020年春节期间举行的《中国诗词大会》第五季精彩纷呈,体现了中国诗词博大精深,下列诗词分析错误的是
A.“弄风柳絮疑成雪,满地榆钱买得春”中的“柳絮”和棉花的成分均含纤维素
B.“日暮汉宫传蜡烛,轻烟散入五侯家”中的“蜡烛”是高级脂肪酸酯,也是高分子化合物
C.“炎炎日正午,灼灼火俱燃”中的“炎炎”体现自然界中太阳能与热能的转化
D.“煮豆持作羹,漉鼓以为汁”中的“漉鼓”涉及的基本操作是过滤
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下,1L pH = 2 的 NaHSO4 溶液中, NaHSO4和水电离的 H+总数为 0.0 1NA
B.公共场所用 75%的乙醇杀菌消毒预防新冠肺炎, 1mol 乙醇分子中含有的共价键数目为 7 NA
C.常温常压下, 等物质的量的N2和CO所含的分子数目均为NA
D.10g 46% 甲酸 (HCOOH) 水溶液中所含的氧原子数为 0.2 NA
难度: 中等查看答案及解析
-
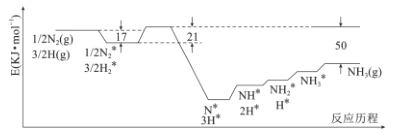
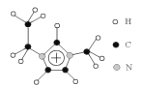
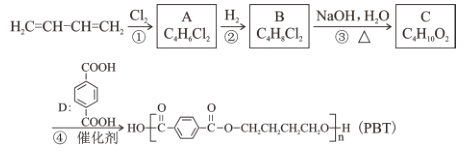
研究治愈新冠肺炎的药物是控制疫情的重要手段之一。药物卡莫氟通过在体内释放氟尿嘧啶, 对新型冠状病毒在体内的复制可能具有抑制作用。下图是其合成的前体之一, 某同学对其认识正确的是
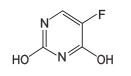
A.分子式为 C4H2N2O2F B.属于芳香族化合物
C.在一定条件下可发生取代反应、加成反应 D.所有原子一定处于同一平面
难度: 简单查看答案及解析
-
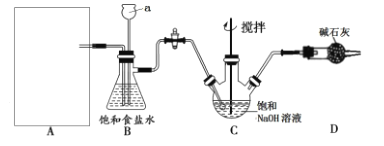
实验室研究某些气体的性质可用如图所示装置,下列过程和结论均正确的是
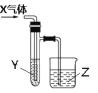
项选
X
Y
Z
结论
A
Br2
苯
NaOH 溶液
苯与溴发生取代反应
B
SO2
酸性KMnO4溶液
NaOH 溶液
二氧化硫具有漂白性
C
HCl
Na2SiO3溶液
NaCl 溶液
Cl 的非金属性强于Si
D
CH2= CH2
Br2 的CCl4溶液
AgNO3溶液
乙烯与Br2发生加成反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
由我国地质学家首次发现的香花石被誉为“矿石熊猫”。它 由 X ( Ca ) 和 前 18 号元素中的 5 种组成,分别为 Y、Z、W、R、T。其中 Y、Z 为金属元素, X、Z 同主族 , Y 、Z 、 R 、 T 位于同周期 ,R 最外层电子数是次外层的 3 倍, T 无正价, X 与 R 原子序数之和是W 的 2 倍。下列说法错误的是
A.XR2、 WR2 两种化合物中 R 的化合价不相同 B.原子半径: T > R > Z > Y
C.最高价氧化物对应的水化物的碱性: X > Z D.气态氢化物的稳定性 : W< R < T
难度: 中等查看答案及解析
-
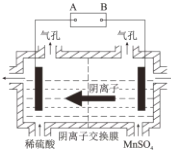
中国科学院大连化物所的研究团队创新性提出锌碘单液流电池的概念, 实现锌碘单液流中电解液的利用率近 100%, 其原理如图所示。
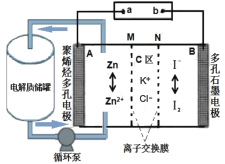
下列说法正确的是
A.放电时A电极反应式为:Zn+2e-=Zn2+ B.放电时电解质储罐中离子总浓度减小
C.M为阴离子交换膜,N为阳离子交换膜 D.充电时A极增重65g,C区增加离子数为2NA
难度: 中等查看答案及解析
-
已知AG=lg
,电离度a=
×l00%。常温下,向l0mL0.lmol•L-1HX溶液中滴加0.lmol•L-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
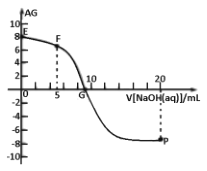
A.点P前随着NaOH溶液的加入,
增大 B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)>c(HX) D.常温下,HX的电离度约为0.1%
难度: 困难查看答案及解析