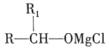-
化学与生产、生活密切相关。下列说法错误的是
A.75%酒精、84消毒液都能杀死新冠病毒,其消毒原理不同
B.医疗废弃物经处理可加工成儿童玩具,实现资源综合利用
C.护肤霜中甘油作保湿剂是利用了丙三醇的吸水性
D.N95口罩主要材质是聚丙烯,工业上利用丙烯加聚合成
难度: 中等查看答案及解析
-
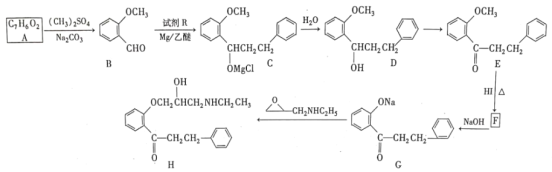
一种合成强效降血脂药物(G)的“片段”如下:
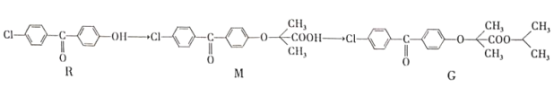
下列说法正确的是
A.R、M、G都能发生加成、取代反应 B.R、M、G都有3种含氧官能团
C.M分子中所有碳原子可能共平面 D.G分子中苯环上二溴代物有6种
难度: 困难查看答案及解析
-
蓝矾(CuSO4·5H2O)常作杀菌剂。某小组设计如图1装置制备蓝矾,实验原理: Cu+CuCl2=2CuCl,4CuCl+O2+2H2O=2[Cu(OH)2·CuCl2],[Cu(OH)2·CuCl2]+H2SO4=CuSO4+CuCl2+2H2O。
操作步骤:向三颈瓶加入3.2 g Cu粉和适量稀硫酸及30 mL 1 mol·L-1 CuCl2溶液,利用二连球向三颈瓶中鼓入空气,铜溶解。当三颈烧瓶中呈乳状浑浊液时,滴加浓硫酸,得到蓝矾(不考虑氯化铜转化成硫酸铜)。下列说法正确的是
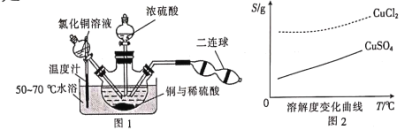
A.盛装CuCl2溶液的仪器是长颈漏斗 B.在实验过程中,浓硫酸作氧化剂
C.采用重结晶法提纯CuSO4·5H2O D.理论上可以制备20 g CuSO4·5H2O
难度: 困难查看答案及解析
-
主族元素R、X、Y、Z原子序数依次增大,R和X能组成两种液态化合物(常温常压),X和Y能组成两种离子化合物,Z原子最外层电子数是次外层电子数的一半。下列说法错误的是
A.含R、X、Y三种元素的化合物为强碱
B.R、X、Z组成的化合物M能稳定存在于自然界
C.ZX2常用于制造光导纤维
D.最简单气态氢化物稳定性:X>Z
难度: 中等查看答案及解析
-
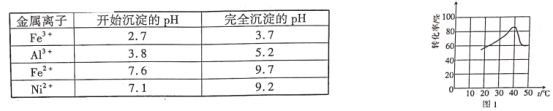
如图为室温时不同pH下磷酸钠盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、12.66,其中δ表示含磷微粒的物质的量分数。下列说法正确的是
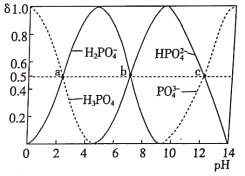
A.选择酚酞作指示剂,用NaOH溶液滴加磷酸溶液的反应为H3PO4+3OH-=PO
+3H2O
B.室温下,水电离的c(H+)·c(OH-):a<b<c
C.a、b、c点对应水溶液中c(H3PO4)+c(H2PO
)+c(HPO
)+c(PO
)之和相等
D.室温下,H3PO4的第三级电离常数的数量级为10-12
难度: 中等查看答案及解析
-
H2是一种绿色能源,如图装置电解水(添加少量烧碱)制备H2和O2。下列说法错误的是
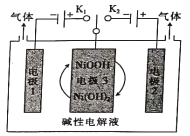
A.关闭K1时,电极1收集H2且电极1附近NaOH溶液浓度减小;
B.关闭K2时,阴极反应为NiOOH+H2O+e-=Ni(OH)2+OH-
C.NaOH增强导电性,可以用稀硫酸(或盐酸)替代烧碱
D.若电极2收集到11200 mL气体(标准状况),则转移2 mol电子
难度: 困难查看答案及解析
-
我国科学家成功地在铁掺杂W18O49纳米催化剂表面常温下获得较高的氨产量,反应历程如图所示(★表示被吸附在催化剂表面的物种)。下列说法错误的是
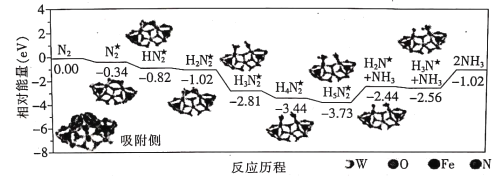
A.需要吸收能量的最大能垒(活化能)E=1.54eV
B.吸收能垒为1.29 eV步骤的反应为H5N2★=NH3+H2N★
C.选择镍掺杂W18O49纳米催化剂获得反应历程与上述不同
D.投料比[
]越大,单位时间内合成氨的产量越高
难度: 困难查看答案及解析
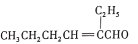
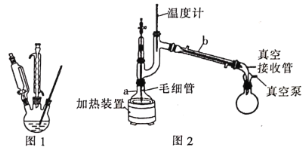
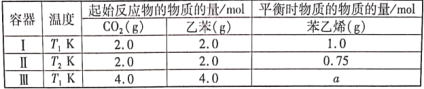
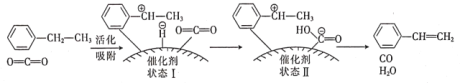
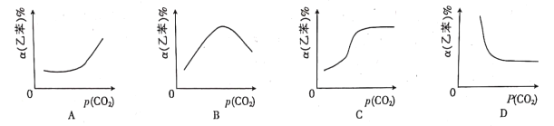
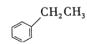 (g)+CO2(g)
(g)+CO2(g)