-
化学与科技、社会生活有着密切的联系,下列有关说法正确的是( )
A.2009年我国起征燃油税,工业上将石油分馏得到汽油,主要发生了化学变化
B.2008年诺贝尔化学奖授予研究绿色荧光蛋白的科学家,区分蛋白质溶液和葡萄糖溶液可利用丁达尔效应
C.“显世闻名”的奶粉事件中污染物为三聚氰胺(结构如图),其摩尔质量为l26g
D.2008年支援四川灾区的生活用品中食醋、纯碱、食盐的主要化学物质分别属于酸、碱、盐
难度: 简单查看答案及解析
-
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O
+O2 +4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A.O2和S2O
是氧化剂,Fe2+是还原剂
B.每生成1mol Fe3O4,则转移电子数为2mol
C.参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D.若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
难度: 简单查看答案及解析
-
下列离子方程式中书写正确的是( )
A.向硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]的稀溶液中逐滴加入足量Ba(OH)2稀溶液:
NH4++Fe2++SO42-+ Ba2++3OH- = BaSO4↓+ Fe(OH)2↓ +NH3·H2O
B.二氧化硫通入氯化铁溶液:SO2+2Fe3++4H+=SO42-+2Fe2++2H2O
C.H218O2中加入酸性高锰酸钾溶液:5H218O2 +2MnO4-+6H+=2Mn2++518O2↑+8H2O
D.用惰性电极电解氯化镁溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
难度: 简单查看答案及解析
-
下列有关分类的观点正确的是( )
①由苯制取溴苯、硝基苯、环己烷的反应都属于取代反应;
②铅蓄电池、锂电池、碱性锌锰电池都属于二次电池;
③碳素钢、不锈钢和目前流通的硬币都属于合金;
④生物质能、沼气和乙醇都是可再生能源;
⑤氨水、醋酸、氢氧化铝都属于弱电解质。
A.①② B.②④ C.③④ D.③⑤
难度: 简单查看答案及解析
-
用S-诱抗素制剂,可以保证鲜花盛开。S-诱抗素的结构如图,下列关于该物质的说法正确的是 ( )
A.其分子中含有两个手性碳原子
B.既能发生加聚反应,又能发生缩聚反应
C.1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH
D.既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
下列装置图或曲线图与对应的叙述相符的是( )

A.图1:固体KNO3中混有NaCl,可用重结晶进行提纯
B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去
C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g)
2SO3(g) ΔH<0”的平衡常数K正、K逆随温度
难度: 简单查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是 ( )
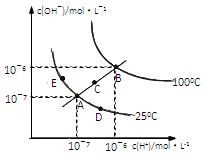
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl 固体的变化
难度: 简单查看答案及解析

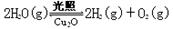 △H >0
△H >0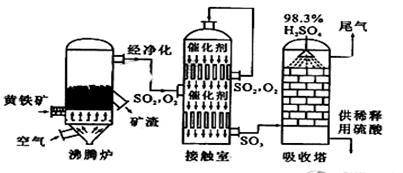
 )是食品添加剂的增香原料。
)是食品添加剂的增香原料。