-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A.X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B.原子半径大小:X<Y,Z>W
C.化合物Z2Y和ZWY3都只存在离子键
D.Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,6.4g氧气和臭氧混合气体中含有的原子总数为0.4NA
B. 常温常压下,22.4LCl2中含有的分子数为NA
C. 1L1mol/LK2SO4溶液中含有的钾离子数为NA
D. 1mol钠变为Na+失去的电子数为11NA
难度: 简单查看答案及解析
-
下列叙述中正确的是
A. 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B. 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
C. 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D. 向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
难度: 中等查看答案及解析
-
鉴别甲烷、一氧化碳和氢气三种无色气体的方法是( )
A.通入溴水→通入澄清石灰水
B.点燃→罩上涂有澄清石灰水的烧杯
C.点燃→罩上干燥的冷烧杯→罩上涂有澄清石灰水的烧杯
D.点燃→罩上涂有澄清石灰水的烧杯→通入溴水
难度: 中等查看答案及解析
-
下列关于实验操作的叙述中正确的是( )
①从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 ②可燃性气体点燃之前必须验纯
③用胶头滴管向试管中滴加液体,一定要将胶头滴管伸入试管中
④用托盘天平称量固体药品时,应左物右码
⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时揽拌和冷却
⑥选用
量筒量取
稀硫酸
A.①③④⑤ B.①③④⑥
C.②④⑤ D.以上答案均不正确
难度: 简单查看答案及解析
-
下列关于钠的化合物的叙述不正确的是
A.热稳定性:
B.
与
都能和水反应生成碱,它们都是碱性氧化物
C.碳酸氢钠可用于治疗胃酸过多
D.
中阴、阳离子的个数比为1:2
难度: 中等查看答案及解析
-
下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜放入医用酒精中
A.②③①④ B.③②①④ C.③①②④ D.①②③④
难度: 简单查看答案及解析
-
工业上以铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
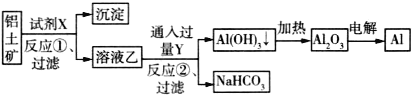
下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
D.图中所有反应都不是氧化还原反应
难度: 中等查看答案及解析
-
将agFe2O3、Al2O3的混合固体溶解在200mL0.1mol/L的过量硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为()
A.0.1mol/L B.0.2mol/L C.0.4mol/L D.0.8mol/L
难度: 简单查看答案及解析
-
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是( )
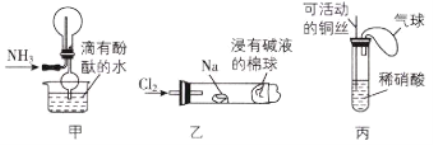
①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠反应的实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A.②③④ B.①②③ C.①②④ D.①③④
难度: 中等查看答案及解析
-
某溶液既能溶解Al(OH)3,又能溶解Al,但不能溶解Fe,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、
、
B.Na+、
、Cl-、S2-
C.
、Mg2+、
、
D.H+、K+、Cl-、Na+
难度: 简单查看答案及解析
-
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
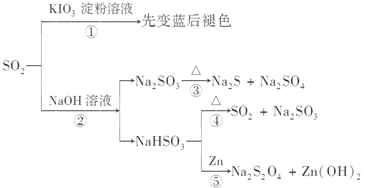
A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
难度: 中等查看答案及解析
-
海藻中含有丰富的碘元素,如图是实验室从海藻中提取捵的部分流程:
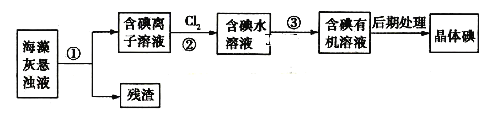
下列判断不正确的是
A.步骤①、③的操作分别是过滤、萃取分液
B.步骤②中反应的离子方程式为:
C.可用淀粉溶液检验步骤②中的反应是否进行完全
D.步骤③中加入的有机溶剂可以是
难度: 中等查看答案及解析
-
A、B、C、D是4种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知A的一种核素可表示为
,该核素中有10个中子,简单离子B+与Ne原子的核外电子排布相同,C的单质是一种常见的半导体材料,D的最高价氧化物对应水化物的分子式为HDO4。下列说法不正确的是( )
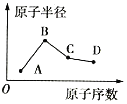
A.B的简单离子半径小于D的简单离子半径
B.气态氢化物的稳定性:C<D
C.A、B、D元素组成的某种化合物能用于杀菌消毒
D.C的氧化物与B和D的最高价氧化物对应的水化物均能反应
难度: 中等查看答案及解析
-
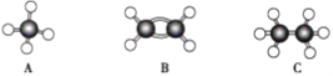
科学家已获得了气态
分子,其结构为正四面体(如图所示)。已知断裂1mol N-N键吸收167kJ能量,断裂1mol
键吸收942kJ能量,下列说法正确的是( )
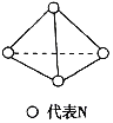
A.
属于一种新型的化合物
B.1mol
(g)完全转化为N(g)的过程中释放1002kJ能量
C.1mol
(g)完全转化为
(g)时放出882kJ能量
D.
和
互为同素异形体,
转化为
属于物理变化
难度: 中等查看答案及解析
-
环境保护是目前人类面临的一项重大课题。为应对燃料使用造成的环境污染,科学家提出了利用太阳能促进燃料循环使用的构想,其构想可用下图表示:
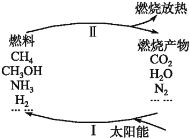
其中过程Ⅰ的主要反应为①2CO2
2CO+O2,②2H2O
2H2↑+O2↑,③2N2+6H2O
4NH3+3O2,④2CO2+4H2O
2CH3OH+3O2,⑤CO2+2H2O
CH4+2O2。
下列说法中不正确的是
A.过程Ⅱ中发生的反应均为放热反应
B.太阳能最终主要转化为热能
C.经过上述一个循环后放出O2
D.要实现上述循环,当前需要解决的关键问题是过程Ⅰ
难度: 中等查看答案及解析
-
有一种银锌微型纽扣电池.其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,电池总反应为 Ag2O+Zn=2Ag+ZnO。下列有关叙述中不正确的是
A. Zn为负极、Ag2O为正极
B. 电池工作时,正极质量逐渐减小
C. 电池工作时,电子由Zn极经外电路流向Ag2O极
D. 电路中每通过0.2mol电子,负极的质量理论上减少6.5g
难度: 中等查看答案及解析
-
纽扣电池可作计算器、电子表等的电源。有一种纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液,放电时两个电极反应分别为Zn-2e-+2OH-=Zn(OH)2,Ag2O+H2O+2e-=2Ag+2OH-,下列说法正确的是( )
A.Zn发生还原反应,Ag2O发生氧化反应
B.溶液中OH-向Ag2O极移动,K+向Zn极移动
C.在电池放电过程中,KOH溶液的浓度保持不变
D.Zn是负极,Ag2O是正极
难度: 中等查看答案及解析
-
下列说法中可以说明2HI(g)
H2(g)+I2(g)已达到平衡状态的是( )
(1)单位时间内生成n mol H2的同时生成n mol HI
(2)一个H—H键断裂的同时有两个H—I键断裂
(3)c(HI)= c(I2)
(4)反应速率υ(H2)=υ(I2)=0.5υ(HI)
(5)c(H2)∶c(I2)∶c(HI)=2∶1∶1
(6)温度和体积一定时,某一生成物浓度不再变化
(7)温度和体积一定时,容器内压强不再变化
(8)条件一定,混合气体的平均相对分子质量不再变化
(9)温度和体积一定时,混合气体的颜色不再发生变化
(10)温度和压强一定时,混合气体的密度不再发生变化
A.(1)(2)(5)(9)(10) B.(2)(6)(9) C.(6)(7)(10) D.全部
难度: 困难查看答案及解析
-
硫酸是一种重要的化工产品,目前硫酸的主要生产方法是“接触法”,其主要反应之一为2SO2+O2
 2SO3。下列有关该反应的说法不正确的是( )
2SO3。下列有关该反应的说法不正确的是( )A.SO2和O2不可能全部转化为SO3
B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C.该反应从开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.工业上生产SO3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
难度: 简单查看答案及解析
-
正己烷是优良的有机溶剂,其球棍模型为
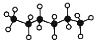 。下列有关说法正确的是( )
。下列有关说法正确的是( )A.正己烷的分子式为C6H12
B.正己烷的一氯代物有3种
C.正己烷能与溴水发生取代反应而使溴水褪色
D.正己烷的同分异构体中,主链上有4个碳原子的有机物只有1种
难度: 简单查看答案及解析
-
两种气态烃组成的混合气体0.1mol,完全燃烧得0.15mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是
A.一定有C2H4 B.一定没有C2H4 C.一定有乙烷 D.一定有甲烷
难度: 简单查看答案及解析
-
实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
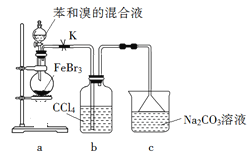
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b中的液体逐渐变为浅红色
C.装置c中的碳酸钠溶液的作用是吸收溴化氢
D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
难度: 中等查看答案及解析
-
2,3-二甲基-2-丁烯的结构简式是
A.
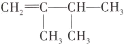 B.
B.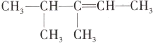
C.
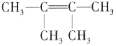 D.
D.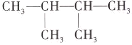
难度: 中等查看答案及解析
-
等物质的量的下列物质:CH2=CHCH=CH2
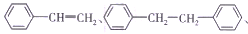
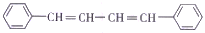 分别与足量氢气发生加成反应,消耗氢气的物质的量之比为
分别与足量氢气发生加成反应,消耗氢气的物质的量之比为A.1:2:3:4 B.1:2:3:5 C.2:4:6:7 D.2:4:7:8
难度: 简单查看答案及解析