-
下列化学用语或模型表示正确的是( )
A.CH4的空间充填模型:

B.乙烯的结构简式:CH2=CH2
C.35Cl-和37Cl-离子结构示意图均可表示为:

D.羟基的电子式:
难度: 简单查看答案及解析
-
下列反应中,属于加成反应的是( )
A.CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O
B.2CH3CHO+O2
2CH3COOH
C.CH3—CH=CH2+Br2→CH3—CHBr-CH2Br
D.
+Br2
+HBr
难度: 简单查看答案及解析
-
化学与生产、生活、社会密切相关。下列说法正确的有( )
①SO2具有还原性,可用于蔗糖脱色
②汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
③SiO2具有导电性,可用于制造光导纤维
④自然界中不存在游离态的硫
⑤硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
⑥浓硫酸可用来干燥SO2、CO、Cl2等气体
⑦水玻璃可用于生产黏合剂和防火剂
A.1个 B.2个 C.3个 D.4个
难度: 中等查看答案及解析
-
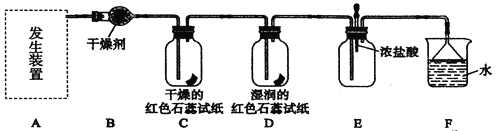
某同学利用下图进行喷泉实验,已知圆底烧瓶内充满X气体,胶头滴管内装有少量Y液体,烧杯内装有足量Z液体,下列组合能进行喷泉实验且最终液体一定能充满整个烧瓶的是( )
X气体
Y试剂
Z试剂
A.
NO2
H2O
H2O
B.
CO2
H2O
H2O
C.
HCl
饱和食盐水
水
D.
NO2 和O2
H2O
H2O
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.正戊烷、异戊烷、新戊烷互为同分异构体
B.淀粉、纤维素和油脂都属于天然高分子化合物
C.四氯乙烯分子中所有原子都处于同一平面
D.等质量的C2H2、C2H4、CH4分别在氧气中完全燃烧,消耗氧气的量依次增多
难度: 中等查看答案及解析
-
化合物如下图,下列说法正确的是


A.a的一氯代物有三种
B.b能使酸性高锰酸钾和溴水褪色,且二者褪色原理相同
C.c中所有原子不可能处于同一平面内
D.a与d互为同分异构体
难度: 中等查看答案及解析
-
对于苯乙烯的下列叙述
①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;
⑤苯环能与溴水发生取代反应;⑥所有的原子可能共面,且最多有5个原子共线。其中完全正确的是
A. ①②④ B. ①②④⑥ C. ①②④⑤⑥ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是 ( )
选项
不纯物质
除杂试剂
分离方法
A
乙烷(乙烯)
KMnO4(酸化)
洗气
B
溴苯(溴)
NaOH溶液
分液
C
苯(乙烯)
溴水
分液
D
CO2(SO2)
碳酸钠溶液
洗气
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
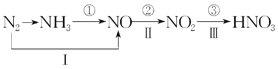
用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯可制聚苯乙烯。生产过程如下:
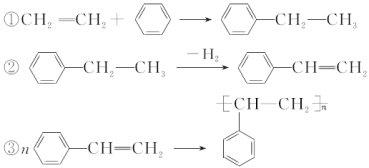
下列说法不正确的是( )
A. 通过裂解可以从石油中获得更多的乙烯
B. 通过煤的干馏不能直接得到纯净的苯
C. 制聚苯乙烯的反应①为加成反应
D. 反应①②③的原子利用率都达到了100%
难度: 中等查看答案及解析
-
下列说法正确的有( )
①SiO2和CO2两者都是酸性氧化物,都能与水反应生成对应的酸
②铵盐不稳定,受热分解都产生氨气
③由于浓硫酸有强氧化性,因此不能用铁罐存浓硫酸
④浓硝酸不稳定,实验保存在无色试剂瓶中
⑤浓硫酸具有强氧化性,稀硫酸无氧化性
⑥氨气是一种碱性气体,可用碱石灰或CaCl2干燥
⑦浓硫酸与铜的反应中,浓硫酸只表现强氧化性
⑧硅晶体是一种重要的半导体材料,可制作计算机芯片
A.无 B.1个 C.2个 D.3个
难度: 简单查看答案及解析
-
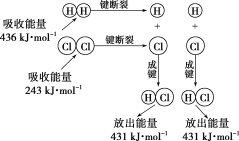
下列说法或表示法正确的是
A.在稀溶液中:H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ
B.由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大
C.已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ·mol﹣1,则H2的燃烧热等于241.8 kJ·mol﹣1
D.己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)===SO2(g):△H2,则△H1<△H2
难度: 中等查看答案及解析
-
下列关于能量变化的说法,正确的是( )
A.将等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同
B.2Na+2H2O=2NaOH+H2↑,该反应生成物的总能量高于反应物的总能量
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测出的中和热数值偏小
D.化学键的断裂是吸热过程,并且一定发生了化学变化
难度: 中等查看答案及解析


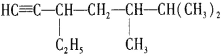 的名称是____________,将其在催化剂存在下完全与H2加成,所得烷烃的名称是___________
的名称是____________,将其在催化剂存在下完全与H2加成,所得烷烃的名称是___________