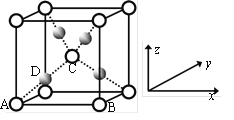
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.0.1mol·L-1某二元弱酸酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.25℃,pH=12的氨水和pH=2的盐酸溶液等体积混合:c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大
D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-)
难度: 中等查看答案及解析
-
2020 年全球多个国家出现新型冠状病毒,此病毒具有非常强的传染性。一次性医用口罩、84 消毒液、75%的医用酒精、过氧乙酸等是防疫期间常用物品。下列说法正确的是
A.口罩用 84 消毒液消毒后可重复使用
B.生产口罩的关键材料聚丙烯属于新型无机材料
C.过氧乙酸和 84 消毒液均具有较强氧化性
D.75%的医用酒精和 84 消毒液混合使用效果更好
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.在标准状况下,78.0 g苯中含有碳碳双键的数目为3NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.在标准状况下,2.24 L CHCl3中所含碳氢键的数目为0.1NA
D.0.1 mol•L-1的Na2CO3溶液中,
的数目小于0.1NA
难度: 中等查看答案及解析
-
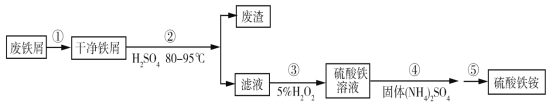
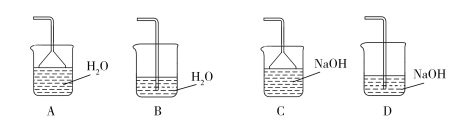
下列实验装置能达到相应实验目的的是
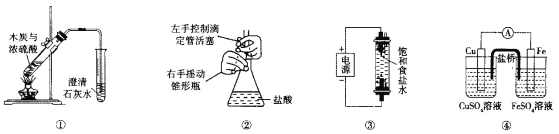
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
难度: 简单查看答案及解析
-
秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如图所示,有关其性质叙述不正确的是( )
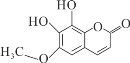
A.该有机物分子式为C10H8O5
B.分子中有四种官能团
C.该有机物能发生加成、氧化、取代等反应
D.1mol该化合物最多能与3molNaOH反应
难度: 中等查看答案及解析
-
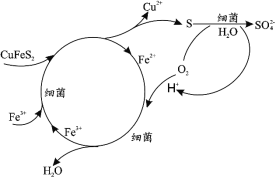
ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法错误的是( )

A.该装置不可以在高温下工作 B.X、Y依次为阴离子、阳离子选择性交换膜
C.负极反应为CH3COO-+2H2O+8e-=2CO2↑+7H+ D.该装置工作时,化学能转化为电能
难度: 中等查看答案及解析
-
X、Y、Z、W 均为短周期元素 , 它们在周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍, 下列说法中正确的是
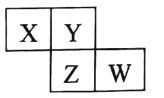
A.最高价氧化物对应水化物的酸性Z比W强
B.只由这四种元素不能组成有机化合物
C.与Z的单质相比较,Y的单质不易与氢气反应
D.X、Y形成的化合物都是无色气体
难度: 中等查看答案及解析