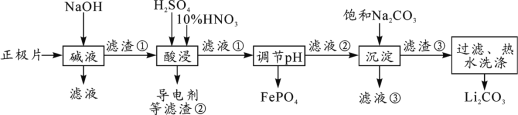
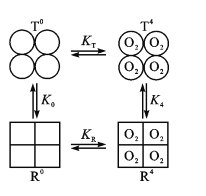
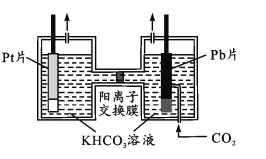
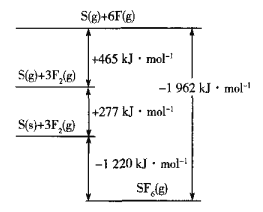
-
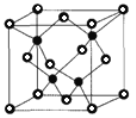
X、Y、Z三种元素都是短周期的主族元素。X是同周期主族元素中原子半径最大的元素;Y元素的原子的最外层电子数是其所在周期数的二倍;Z元素原子的最外层电子数是其所在周期数的三倍。下列有关叙述中正确的是
A.用惰性电极电解由X、Y、Z形成的化合物的水溶液,电解后溶液的pH值一定增大
B.由X、Y、Z形成的化合物的分子式一定为X2YZ3
C.由X、Y、Z形成的化合物的水溶液可能呈酸性、中性或碱性。
D.X元素形成的单质晶体可能为金属晶体,Y、Z两元素形成的单质晶体一定为分子晶体
难度: 中等查看答案及解析
-
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A.新型材料聚酯纤维、光导纤维都属于有机高分子
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 0.1 mol·L-1NaClO溶液中含有的ClO-为NA
B. 1 mol Fe在1 mol Cl2中充分燃烧,转移的电子数为3NA
C. 常温常压下,32 g O2与O3的混合气体中含有的分子总数小于NA
D. 标准状况下,22.4 L HF中含有的氟原子数目为NA
难度: 中等查看答案及解析
-
由下列实验、现象以及由现象推出的结论均正确的是
选项
实验方法
现象
结论
A
SO2通入Ba(NO3)2溶液
产生白色沉淀
白色沉淀是BaSO3
B
向FeCl3溶液中滴入过量 KI 溶液,再加入几滴KSCN溶液
溶液变红
Fe3+与I-的反应具有可逆性
C
将稀硫酸滴入淀粉溶液中并加热,冷却后,再加入新制Cu(OH)2悬浊液并加热
未出现砖红色沉淀
淀粉未水解
D
用碎瓷片做催化剂,给石蜡油加热分解,产生的气体通过酸性高锰酸钾溶液
酸性高锰酸钾溶液逐渐褪色
石蜡油裂解一定生成乙烯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
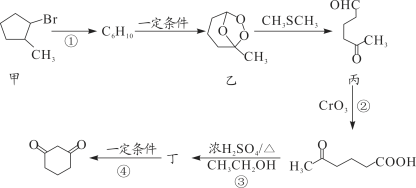
化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
下列说法正确的是
A.X的分子式为C7H6O2 B.Y分子中的所有原子可能共平面
C.Z的一氯取代物有6种 D.Z能与稀硫酸发生水解反应
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.用苯萃取溴水中的Br2,分液时先从分液漏斗下口放出水层,再从上口倒出有机层
B.欲除去CH4气体中混有的乙烯,可将混合气体通入酸性高锰酸钾溶液
C.乙酸乙酯制备实验中,要将导管插入饱和碳酸钠溶液底部以利于充分吸收乙酸和乙醇
D.用pH试纸分别测量等物质的量浓度的NaCN和NaClO溶液的pH,可比较HCN和HClO的酸性强弱
难度: 简单查看答案及解析
-
科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
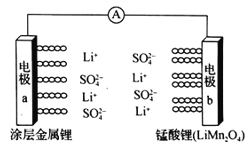
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
难度: 困难查看答案及解析