-
以下反应属于吸热反应的是
A.锌与稀硫酸的反应 B.氯化铵与氢氧化钡晶体反应
C.煤的燃烧 D.氢氧化钠与盐酸的反应
难度: 简单查看答案及解析
-
下列每步转化不能通过一步反应就实现的是
A.NH3→NO→NO2→HNO3
B.Al→Al2O3→Al(OH)3→NaAlO2
C.S→SO2→H2SO4→MgSO4
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
难度: 简单查看答案及解析
-
下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
难度: 中等查看答案及解析
-
某元素的原子最外层只有一个电子,其原子与卤素原子结合时,所形成的化学键( )
A.一定是离子键
B.一定是共价键
C.可能是离子键也可能是共价键
D.以上说法都不正确
难度: 简单查看答案及解析
-
关于离子键、共价键的各种叙述中,说法正确的是( )
A.在离子化合物中,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子中
C.在共价化合物分子内,一定不存在离子键
D.由不同元素组成的多原子分子里,一定只存在极性键
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.NH3易液化,液氨常用作制冷剂
B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.稀HNO3和活泼金属反应时得不到氢气
难度: 简单查看答案及解析
-
下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(难挥发性)
难度: 中等查看答案及解析
-
下列各组物质中,化学键类型不同的是( )
A.NaCl和HNO3 B.H2O和NH3 C.CaF2和CsCl D.CCl4和HCl
难度: 简单查看答案及解析
-
实验室里可按下图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是
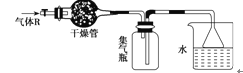
A. HCl B. Cl2 C. CO D. NH3
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中位置如图所示,若W原子最外层电子数是其内层电子总数的
。下列说法中,正确的是( )
A.X只有一种氧化物
B.气态氢化物的稳定性:Z>W
C.原子半径由大到小排列顺序:Z>Y>X
D.元素Y最高价氧化物对应水化物的酸性>元素Z最高价氧化物对应水化物的酸性
难度: 简单查看答案及解析
-
下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
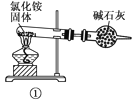
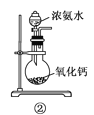
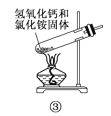
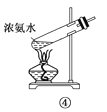
A. ①③ B. ②③
C. ①④ D. ②④
难度: 中等查看答案及解析
-
下列结论正确的是( )
①S2-、Cl、S、F四种微粒半径逐渐减小
②HF、HCl、HBr水溶液酸性逐渐增强
③S2-、Cl-、Br-、I-四种离子的还原性逐渐减小
④Cl2、S、P的氧化性逐渐减弱
⑤H2SO4、HClO4、H2CO3的酸性逐渐减弱
A.②④ B.③⑤ C.①④ D.②③
难度: 简单查看答案及解析
-
下列关于原子序数为87的元素的说法正确的是( )
A.它位于第六周期第ⅡA族 B.它位于第七周期第ⅡA族
C.它位于第七周期第ⅠA族 D.它的原子最外层有3个电子
难度: 简单查看答案及解析
-
下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g)
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)
CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
D.3H2(g)+N2(g)
2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
难度: 简单查看答案及解析
-
下列物质的电子式正确的是( )
A.
B.
C.H+
H+ D.
Mg2+
难度: 简单查看答案及解析
-
在一个容积为2L的密闭容器中,发生如下反应:3A+B
2C(A、B、C均为气体),若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/(L·s),则10s后容器中B的物质的量是( )
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
难度: 简单查看答案及解析
-
W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( )
A.金属性:Y>Z
B.离子的还原性:X>W
C.氢化物的沸点:X>W
D.离子半径:Z>Y>X
难度: 中等查看答案及解析
-
如图所示的原电池,其反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag(放热反应),下列有关说法正确的是( )
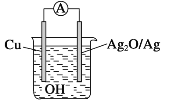
A.2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
B.电池工作时,OH-向正极移动
C.电流方向从Cu经外电路流向Ag2O
D.负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
难度: 简单查看答案及解析
-
如图所示,每条折线表示元素周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化情况,每个小黑点代表一种氢化物,其中a点代表的是( )
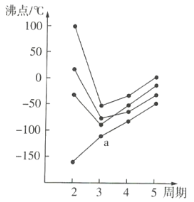
A.H2S B.HCl C.PH3 D.SiH4
难度: 中等查看答案及解析
-
在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是( )
A.B的转化率为20% B.平衡时A的浓度为1.50mol/L
C.x=1 D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
难度: 中等查看答案及解析
-
下列现象或事实可用同一原理解释的是( )
A.不能用pH试纸测定浓硫酸和新制氯水的pH
B.浓硫酸和浓盐酸长期暴露在空气中浓度降低
C.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
D.氢氧化钠固体易潮解和铝制容器可用盛装浓硫酸
难度: 简单查看答案及解析
-
将7g某铜、银合金与足量的amol/LHNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全吸收,则此合金中银的质量是( )
A.1.6g B.2.7g C.3.2g D.5.4g
难度: 中等查看答案及解析
-
X和Y的原子序数都小于18,两者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是( )
A.n+1 B.n-5 C.n+3 D.n-6
难度: 中等查看答案及解析