-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的灭火,也适用于电器灭火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
下列实验操作规范且能达到目的的是
目的
操作
A
取20.00 mL盐酸
在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶
B
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D
配制浓度为0.010 mol·L-1的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.植物油氢化过程中发生了加成反应 B.淀粉和纤维素互为同分异构体
C.环己烷与苯可用酸性KMnO4溶液鉴别 D.水可以用来分离溴苯和苯的混合物
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是
A. 原子半径大小为W<X<Y<Z
B. X的氢化物水溶液酸性强于Z的
C. Y2W2与ZW2均含有非极性共价键
D. 标准状况下W的单质状态与X的相同
难度: 中等查看答案及解析
-
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的
中,含有
个中子
B. pH=1的H3PO4溶液中,含有
个
C. 2.24L(标准状况)苯在O2中完全燃烧,得到
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加
个P-Cl键
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析


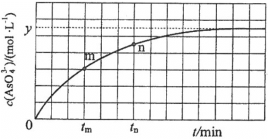
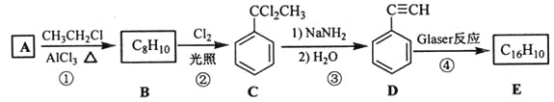
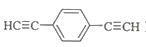 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。