-
“白墙黑瓦青石板,烟雨小巷油纸伞”,是著名诗人戴望舒《雨巷》中描述的景象,下列有关说法中错误的是
A.“白墙”的白色源于墙体表层的CaO
B.“黑瓦”与陶瓷的主要成分都是硅酸盐
C.做伞骨架的竹纤维的主要成分可表示为(C6H10O5)n
D.刷在伞面上的熟桐油是天然植物油,具有防水作用
难度: 简单查看答案及解析
-
已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1mol•L-1H2C2O4溶液中含C2O
离子数为0.1NA
B.2molNO与2molO2在密闭容器中充分反应,转移的电子数为8NA
C.32gS8与S6(
 )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NAD.标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为NA
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,W与X同主族,Y的最外层电子数是电子层数的3倍,Y与W核外电子数相差6,Z的最外层电子数等于电子层数。下列说法正确的是
A.X、Y、W元素的原子半径依次递增
B.Z、W分别与Y形成的化合物均可作为耐高温材料
C.X、W分别与Y形成化合物在常温下均为气态
D.X、Z、W元素的最高价氧化物的水化物的酸性依次递增
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A
向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐期消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)<Ksp(AgCl)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A.将Fe2O3加入到HI溶液中:Fe2O3+6H+=2Fe3++3H2O
B.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++H2O=4Na++2Cu(OH)2↓+O2↑
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S+2Cl-
D.已知电离平衡常数:H2CO3>HClO>HCO
,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO
难度: 中等查看答案及解析
-
T℃下,三种硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )

A.溶度积:BaSO4>PbSO4>SrSO4
B.Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4
C.Z点对应的溶液中c(Ba2+)>c(SO42-),c(Ba2+)·c(SO42-)等于1×10-25
D.BaSO4不可能转化成PbSO4
难度: 困难查看答案及解析
-
乳酸乙酯(
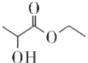 )是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)
)是一种食用香料,常用于调制果香型、乳酸型食用和酒用精。乳酸乙酯的同分异构体M有如下性质:0.1mol M分别与足量的金属钠和碳酸氢钠反应,产生的气体在相同状况下的体积相同,则M的结构最多有(不考虑空间异构)A. 8种 B. 9种 C. 10种 D. 12种
难度: 中等查看答案及解析
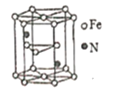
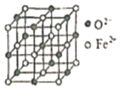
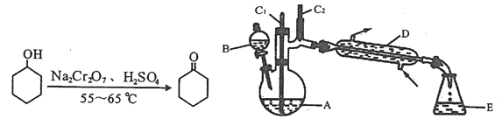
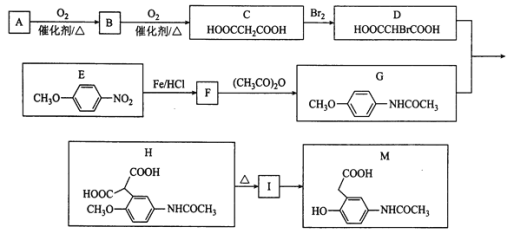
 (-NH2容易被氧化);
(-NH2容易被氧化);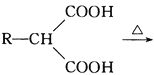 R-CH2COOH
R-CH2COOH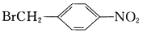 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备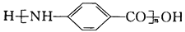 的合成路线:___。
的合成路线:___。