-
对于下列事实的解释正确的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 中等查看答案及解析
-
下列说法不正确的是 ( )。
A. 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解
B. 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
C. 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-===3Cu2++2NO↑+ 4H2O
D. HNO3→NO→NO2,以上各步变化均能通过一步实现
难度: 中等查看答案及解析
-
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是
A.氧化剂 B.还原剂 C.催化剂 D.载体
难度: 简单查看答案及解析
-
下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成NO2 ②铵盐都不稳定,受热分解都生成氨气 ③向Fe(NO3)2溶液中滴加稀盐酸,无明显的变化 ④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
A. ①③④ B. ①③
C. ①④ D. ①②③④
难度: 中等查看答案及解析
-
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫 B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅 D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
难度: 中等查看答案及解析
-
SO2能使浸过溴水的滤纸褪色,这说明了( )
A. SO2具有漂白性 B. 溴具有氧化性
C. SO2具有氧化性 D. 溴具有挥发性
难度: 中等查看答案及解析
-
关于A(g)+2B(g)=3C(g)的化学反应,下列表示的反应速率最大的是( )
A. v(A)=0.6 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·min-1
C. v(C)=1.2 mol·L-1·min-1 D. v(B)=0.03 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.需要加热的反应一定是吸热反应
B.放热反应X(s)=Y(s),则X比Y稳定
C.硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
D.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
难度: 中等查看答案及解析
-
下列反应中,不能说明SO2是酸性氧化物的是( )
A.Na2SO3+2HCl=SO2↑+H2O+2NaCl
B.SO2+2NaOH=Na2SO3+H2O
C.SO2+2H2S=3S↓+2H2O
D.SO2+Na2O=Na2SO3
难度: 中等查看答案及解析
-
下列溶液中能用来区别SO2和CO2气体的是( )
①澄清的石灰水;
②氢硫酸;
③氯水;
④酸性高锰酸钾溶液;
⑤氯化钡溶液;
⑥品红溶液;
A.①⑤ B.③④⑤ C.②③④⑥ D.②③④⑤
难度: 中等查看答案及解析
-
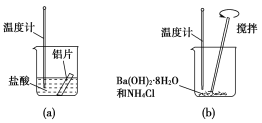
下列反应既是氧化还原反应又是放热反应的是( )
①过氧化钠与水反应
②氨水与稀硫酸的反应
③灼热的炭与CO2反应
④Ba(OH)2与NH4Cl的反应
⑤甲烷在O2中的燃烧
⑥灼热的炭与水蒸气反应
⑦铝片与稀硫酸反应
⑧铝热反应
⑨煅烧石灰石制生石灰
⑩钾与水的反应
A.①⑤⑦⑧⑩ B.①③⑤⑦⑩ C.①②⑤⑦⑧⑩ D.①③⑤⑥⑦⑩
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.10.0 mL 2 mol·L ﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
难度: 简单查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
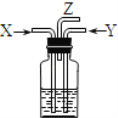
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
难度: 中等查看答案及解析
-
下列检验某溶液中是否含有SO
的方法中正确的是( )
A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO
B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO
C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO
D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO
难度: 简单查看答案及解析
-
把金属A放入盐B(NO3)2的溶液中,发生反应A+B2+=A2++B,以下叙述正确的是( )
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A、B和B(NO3)2溶液构成的原电池,A一定是正极,B一定是负极
难度: 简单查看答案及解析
-
四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。其中原试管充满NO2的是
A.
 B.
B.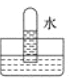 C.
C.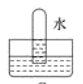 D.
D.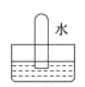
难度: 中等查看答案及解析
-
某实验过程如图所示,则图③试管中的现象是( )
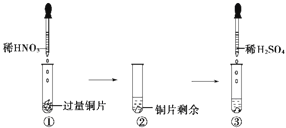
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是( )
A.
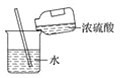 B.
B. 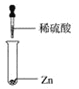 C.
C. 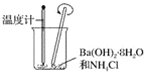 D.
D. 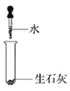
难度: 简单查看答案及解析
-
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
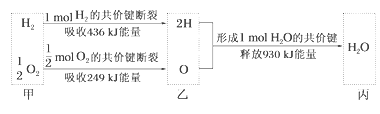
A.生成1molH2O时放出热量245kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
难度: 简单查看答案及解析
-
已知4NH3+5O2=4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) 表示。则正确的关系是( )
A.
υ(NH3)=υ(O2) B.
υ(O2)=υ(H2O)
C.
υ(NH3)=υ(H2O) D.
υ(O2)=υ(NO)
难度: 简单查看答案及解析
-
下列有关铜与过量浓硫酸反应的实验说法不正确的是( )
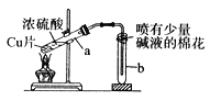
A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
难度: 中等查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A.肯定只有SO2 B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
难度: 中等查看答案及解析
-
根据Zn+Cu2+=Zn2++Cu的反应原理所设计原电池装置,正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
为了更简便地制取干燥的NH3,下列方法中适合的是
A.NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥
B.N2+3H2
2NH3,用烧碱进行干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4HCO3,气体用P2O5干燥
难度: 中等查看答案及解析
-
CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g)
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
难度: 中等查看答案及解析
-
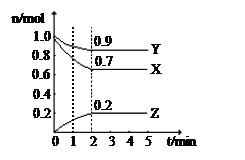
一定条件下的某可逆反应,其正反应速率v(正)和逆反应速率v(逆)随反应时间t的变化如图所示。下列判断不正确的是( )
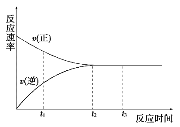
A.t1时刻,v(正)>v(逆)
B.t2时刻,v(正)=v(逆)
C.t2时刻,反应达到最大限度
D.t3时刻,反应停止
难度: 困难查看答案及解析
-
已知空气—锌电池的电极反应为:锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:
O2+H2O+2e-=2OH-。据此判断,锌片是( )
A. 正极并被还原 B. 正极并被氧化
C. 负极并被还原 D. 负极并被氧化
难度: 中等查看答案及解析
-
如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是
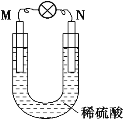
A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
难度: 中等查看答案及解析
-
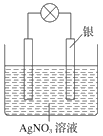
如图:电流计的指针会偏转,M极变粗,N极变细符合这种现象的是
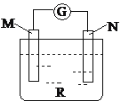
A. M是铜,N是锌,R是硫酸溶液
B. M是锌,N是铜,R是硫酸铜溶液
C. M是银,N是锌,R是硝酸银溶液
D. M是铁,N是铜,R是硝酸铜溶液
难度: 简单查看答案及解析
-
下列方法对2SO2(g)+O2(g)
2SO3(g)的反应速率没有影响的是
A.加入SO3 B.容积不变,充入N2
C.压强不变,充入N2 D.降低温度
难度: 简单查看答案及解析