-
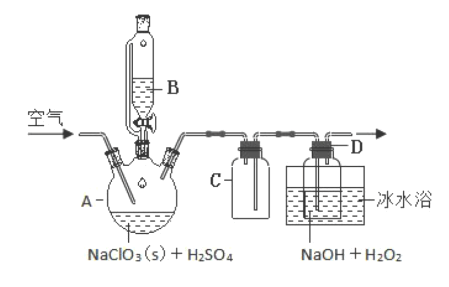
从海带中提取碘的实验中,包括灼烧、浸取和过滤、氧化、萃取、反萃取等步骤。下列说法正确的是( )
A.灼烧中用到的仪器有蒸发皿、三脚架、酒精灯、玻璃棒
B.过滤中用到的仪器只有烧杯、漏斗(带滤纸)、铁架台
C.萃取得到碘的四氯化碳溶液,分液时从分液漏斗上口倒出
D.反萃取是在碘的四氯化碳溶液中加入浓氢氧化钠溶液,振荡、静置、分液,再向水溶液中滴加45%硫酸溶液,过滤得固态碘
难度: 中等查看答案及解析
-
2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884 块ETFE 膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga 处于IIIA 族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE 膜(
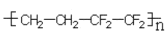 )是由一种单体加聚而成的
)是由一种单体加聚而成的难度: 简单查看答案及解析
-
下列防疫物品的主要成分属于无机物的是




A.聚丙烯
B.聚碳酸酯
C.二氧化氯
D.丁腈橡胶
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
二氧化氯、铁酸钠以及臭氧是饮用水的“三净客”,用铁酸钠(Na2FeO4)处理来自河流湖泊的水,以作为人们生活饮用水,是一项较新的技术。以下叙述中正确的是( )
①二氧化氯对水具有消毒、净化双效功能 ②臭氧可消除水洗物中残留的农药残留,杀灭水中的细菌病毒 ③臭氧、明矾净水原理相同 ④用Na2FeO4净水具消毒和净化双效功能
A.②④ B.③④ C.①③ D.①④
难度: 中等查看答案及解析
-
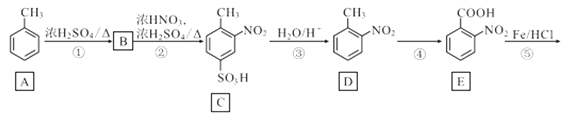
已知:①(
+HNO3
+H2O △H<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
选项
A
B
C
D
装置
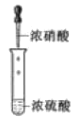
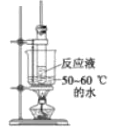
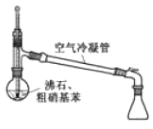
目的
分液
配制混酸
水浴加热
蒸馏提纯
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在 2020 年抗击新型冠状病毒肺炎的战役中,大量防护和消毒用品投入使用,化学品发挥了重要作用,科学防护对预防病毒感染非常重要。下列说法中错误的是
A.聚丙烯和聚四氟乙烯为生产防护服的主要原料,二者均属于有机高分子材料
B.“84” 消毒液、二氧化氯泡腾片可用作环境消毒
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.冠状病毒粒子直径约 60-220 nm, 介于溶液和胶体粒子之间
难度: 简单查看答案及解析
-
短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )
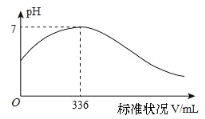
A.X2R 溶液的浓度为0.03mol·L-1
B.最简单气态氢化物的稳定性:Y>Z>R
C.工业上通常采用电解法冶炼Q的单质
D.RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
难度: 困难查看答案及解析
-
当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 mol⸱L−1 的AgNO3溶液,乙池为1 mol⸱L−1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是
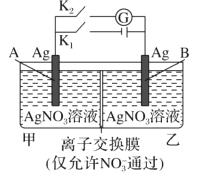
A.实验开始先断开K1,闭合K2,此时
向B电极移动
B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
难度: 中等查看答案及解析
-
酸雨的形成是—种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如图:
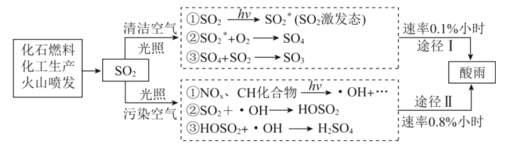
下列有关说法不正确的是
A.所涉及的变化均为氧化还原反应 B.光照是酸雨形成的必要条件之一
C.污染指数越高形成酸雨的速率越快 D.优化能源结构能有效遏制酸雨污染
难度: 简单查看答案及解析
-
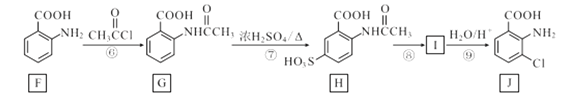
药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是
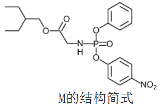
A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
难度: 困难查看答案及解析
-
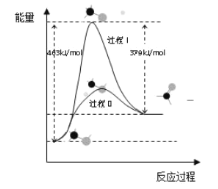
硫酸被用于亚麻织品的漂白、棉织品的酸化和毛织品的染色。吕布兰法的成功,又需大量地从硫酸和食盐制取硫酸钠。迅速增长的需求为初兴的硫酸工业开拓了顺利发展的道路。1874年,天津机械局淋硝厂建成中国最早的铅室法装置,1876年投产,日产硫酸约2t。“接触法制硫酸”的核心反应是: 2SO2 +O2
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
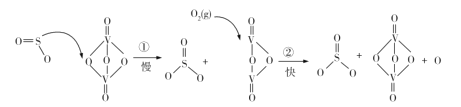
下列说法正确的是
A.反应①的活化能比反应②低
B.总反应的反应速率由反应①决定
C.图示过程中既有 S—O 键的断裂,又有S—O键的形成
D.该反应的催化剂有V2O5和V2O4
难度: 简单查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
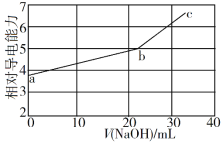
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析