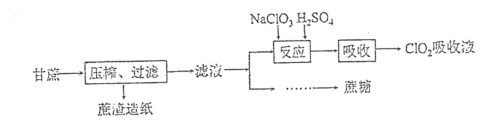
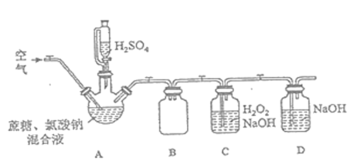
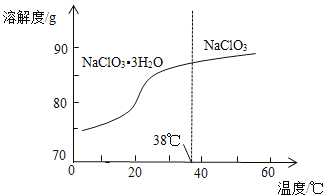
-
化学与生产、生活密切相关。下列叙述不正确的是( )
A.将少量二氧化硫添加到红酒中可起到杀菌和抗氧化作用
B.甘油、生物柴油和汽油都属于烃类物质
C.中国天眼FAST用到的碳化硅是一种无机非金属材料
D.用CO2合成聚碳酸酯可降解塑料可实现碳的循环利用
难度: 简单查看答案及解析
-
次氯酸钠溶液与氨气反应可制备联氨:NaClO+2NH3
N2H4+NaCl+H2O。下列表示相关微粒的化学用语正确的是( )
A.中子数为8的氧原子:
O
B.H2O的电子式:
C.Cl-的结构示意图:
D.N2H4的结构式:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途正确且具有对应关系的是( )
A.FeCl3具有氧化性,可用作铜制线路板的蚀刻剂
B.SiO2可与氢氟酸反应,可用作光导纤维
C.活性炭具有还原性,可用于除去水体中的重金属离子
D.NaHCO3受热易分解,可用于制胃酸中和剂
难度: 简单查看答案及解析
-
常温下,下列溶液中各组离子一定能够大量共存的是( )
A.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、
、Cl-
B.0.1mol·L-1NaAlO2溶液:K+、
、
、
C.
=0.lmol·L-1的溶液:Na+、K+、
、
D.通入足量SO2后的溶液:Na+、Ba2+、ClO-、CH3COO-
难度: 中等查看答案及解析
-
下列有关实验装置正确且能达到实验目的的是( )
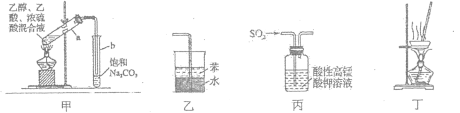
A.用图甲所示装置制取少量乙酸乙酯
B.用图乙所示装置吸收氨气防倒吸
C.用图丙所示装置验证SO2的漂白性
D.用图丁所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
难度: 简单查看答案及解析
-
下列有关物质的性质描述正确的是( )
A.Fe(OH)3溶于氢碘酸生成FeI3
B.Na与CuSO4水溶液反应析出Cu
C.Fe和水蒸气高温下生成Fe2O3
D.稀盐酸与Na2SiO3溶液混合产生H2SiO3
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.向偏铝酸钠溶液中通入过量的CO2:2AlO
+CO2+3H2O=2Al(OH)3↓+CO
B.向HNO2溶液中滴加酸性KMnO4溶液:5NO
+2MnO
+3H2O=5NO
+2Mn2++3OH-
C.向NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH
+H++SO
=BaSO4↓+NH3•H2O+H2O
D.向银氨溶液中滴加乙醛溶液并水浴加热:CH3CHO+2[Ag(NH3)2]++2OH-
CH3COO-+NH
+2Ag↓+H2O+3NH3
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,且X、Z同主族,Y为金属元素,且Y的原子序数小于X和Z的最外层电子数之和,Z原子的最外层电子数与核外电子总数之比为3:8。下列说法正确的是( )
A.原子半径:r(W)>r(Y)>r(X)
B.X与Y组成的化合物中均不含共价键
C.X的简单气态氢化物的热稳定性比Z的强
D.W的氧化物对应的水化物酸性比Z的强
难度: 中等查看答案及解析
-
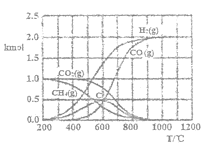
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Fe3O4(s)
Fe(s)
Fe(NO3)2(aq)
B.SO2(g)
CaSO3(s)
CaSO4(s)
C.MgO(s)
MgSO4(aq)
Mg(s)
D.NaOH(aq)
NH3(g)
Na2CO3(s)
难度: 简单查看答案及解析
-
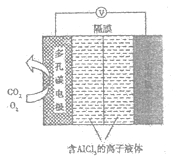
一种镁氧电池电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液,如图所示。下列说法不正确的是( )
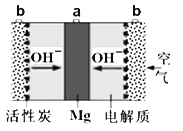
A.正极反应式为:O2+4e-+2H2O=4OH-
B.负极反应式为:Mg-2e-+2OH-=Mg(OH)2
C.电子的移动方向是由a经外电路到b
D.该电池在工作过程中,电解液KOH的浓度保持不变
难度: 简单查看答案及解析
-
传统中草药金银花对治疗“新冠肺炎”有效,其有效成分“绿原酸”可由“奎尼酸”在一定条件下人工合成:
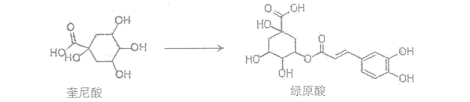
下列说法正确的是( )
A.绿原酸分子中所有碳原子在同一平面内
B.奎尼酸与绿原酸都能与FeCl3溶液发生显色反应
C.绿原酸与足量氢气完全加成,每个产物分子中含有6个手性碳原子
D.等物质的量的奎尼酸与绿原酸分别与足量NaOH溶液反应,最多消耗NaOH的物质的量之比为1:4
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作
现象
结论
A
向蛋白质溶液中加入少量饱和(NH4)2SO4溶液
出现白色沉淀
蛋白质发生了变性
B
将苯、液溴和铁粉混合后产生的气体直接通入AgNO3溶液中
产生淡黄色沉淀
苯和液溴发生了取代反应
C
相同条件下,将SO2和O2按体积比1:1混合并通过灼热的催化剂充分反应,产物依次通过BaCl2溶液和品红溶液
前者溶液中产生白色沉淀,后者溶液褪色
SO2和O2的反应有一定的限度
D
向2支均盛有2mL1.0mol/L的KOH溶液的试管中,分别加入2滴浓度均为0.1mol/L的AlCl3和FeCl3溶液
一支试管出现红褐色沉淀,另一支无明显现象
Ksp[Al(OH)3]> Ksp[Fe(OH)3]
A.A B.B C.C D.D
难度: 简单查看答案及解析
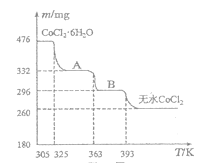
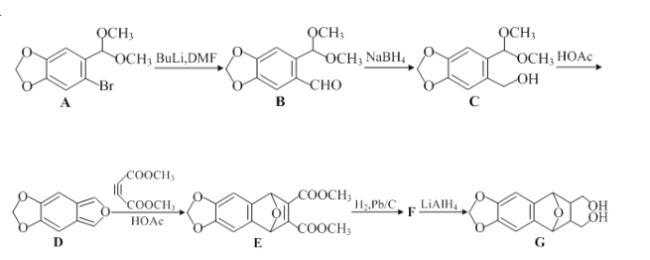
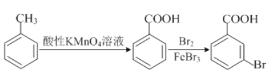 。请以甲苯、BuLi和DMF为原料制备
。请以甲苯、BuLi和DMF为原料制备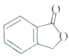 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。____________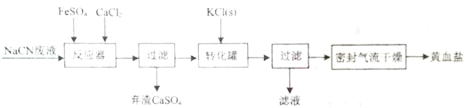
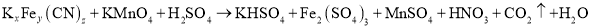 ③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。
③向②所得溶液加入Mn2+离子交换树脂,将Mn2+完全吸附后再滴加足量NaOH溶液,过滤、洗涤、灼烧,最终得固体0.2g。