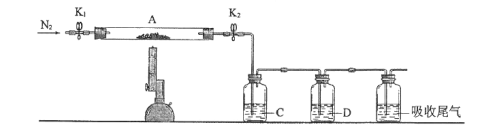
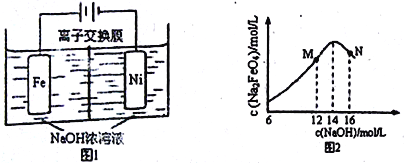
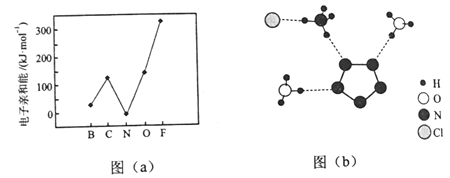
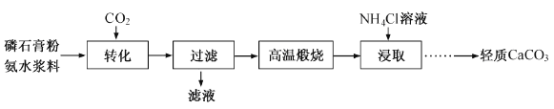
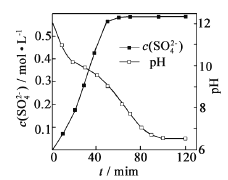
-
下列有关物质性质与用途具有对应关系的是( )
A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
B. ClO2具有还原性,可用于自来水的杀菌消毒
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 mol•L﹣1的溶液中:K+、Na+、CO
、NO
C.c(Fe2+)=1 mol•L﹣1的溶液中:K+、NH
、MnO
、SO
D.能使甲基橙变红的溶液中:Na+、NH
、SO
、HCO
难度: 简单查看答案及解析
-
下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子:
B.氯离子(Cl-)的结构示意图:

C.氯分子的电子式:
D.氯乙烯分子的结构简式:H3C-CH2Cl
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )

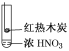
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 困难查看答案及解析
-
金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
难度: 中等查看答案及解析
-
萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )
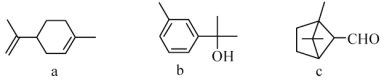
A. a和b都属于芳香族化合物
B. a和c分子中所有碳原子均处于同一平面上
C. a、b和c均能使酸性KMnO4溶液褪色
D. b和c均能与新制的Cu(OH)2反应生成红色沉淀
难度: 中等查看答案及解析