-
化学与生活密切相关。下列说法错误的是( )
A.向汽油中添加甲醇后,该混合燃料的热值不变
B.国产C919所用到的氮化硅陶瓷是新型无机非金属材料
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
B.0.1 mol KI与0.1 mol FeCl3在溶液中反应转移的电子数为0.1NA
C.1 L 0.5 mol·L-1醋酸钠溶液中阴、阳离子总数目大于NA
D.0.1 mol环氧乙烷(
)中含有共价键的总数约为0.3×6.02×1023
难度: 中等查看答案及解析
-
X、Y、Z、R为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与R同周期,R的原子半径小于Z。下列叙述错误的是( )
A.R元素的非金属性最强
B.Y、Z、R与氢形成的化合物中化学键均为极性共价键
C.只有X与其他元素生成的化合物都是离子化合物
D.它们均存在两种或两种以上的氧化物
难度: 中等查看答案及解析
-
某有机化工品R的结构简式如图所示。下列有关R的说法正确的是
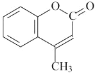
A.R的分子式为C10H10O2
B.苯环上一氯代物有2种
C.R分子中所有原子可共平面
D.R能发生加成、氧化和水解反应
难度: 简单查看答案及解析
-
下列实验操作或装置能达到目的的是( )
A
B
C
D
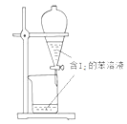
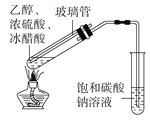
除去SO2中的少量HCl
实验室制取并收集氨气
苯萃取碘水中的I2分出水层后的操作
实验室制备乙酸乙酯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
锂/氟化碳电池稳定性很高。电解质为LiClO4的二甲醚溶液,总反应为xLi+CFx=xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )
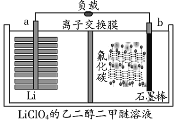
A.交换膜为阴离子交换膜
B.正极的电极反应式为CFx+xe-+xLi+=xLiF+C
C.电解质溶液可用LiClO4的乙醇溶液代替
D.a极电势高于b极电势
难度: 中等查看答案及解析
-
常温下,向25 mL0.12 mol/L AgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加入氨水的体积V与溶液中lg
的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是( )
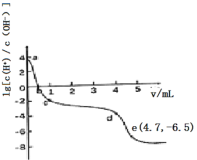
A.a点溶液呈酸性的原因是AgNO3水解
B.b点溶液中:c(Ag+)+c[Ag(NH3)2+]<c(NO3-)
C.由e点可知,反应Ag++2NH3
[Ag(NH3)2]+平衡常数的数量级为105
D.c~d段加入的氨水主要用于沉淀的生成和溶解
难度: 中等查看答案及解析
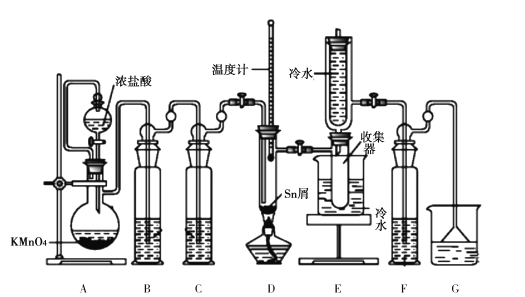
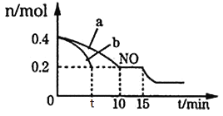
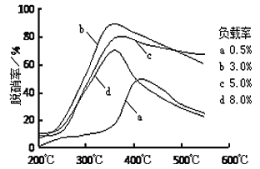
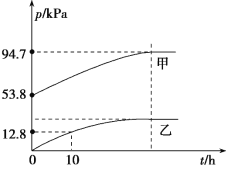
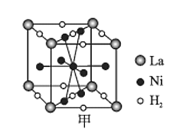
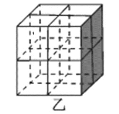
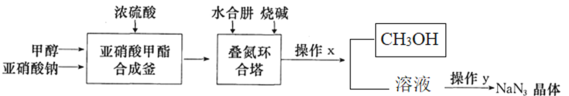
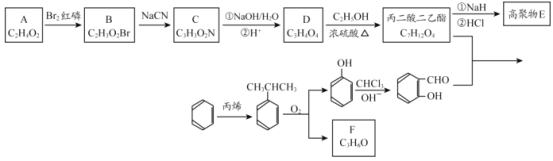
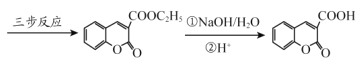
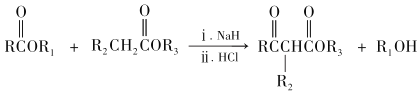
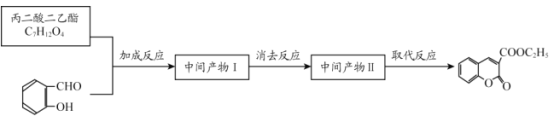
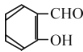 经过三步反应合成
经过三步反应合成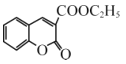 。
。