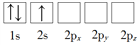
-
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
难度: 简单查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
难度: 中等查看答案及解析
-
下列关于晶体的说法中,不正确的是( )
①晶胞是晶体结构的基本单元
②分子晶体若是密堆积方式,其配位数都是12
③含有离子的晶体一定是离子晶体
④共价键的强弱决定分子晶体熔沸点的高低
⑤MgO远比NaCl的晶格能大
⑥含有共价键的晶体一定是原子晶体
⑦分子晶体的熔点一定比金属晶体低
⑧NaCl晶体中,阴、阳离子的配位数都为6.
A. ①③④⑦ B. ②④⑥⑧ C. ③⑤⑦⑧ D. ③④⑥⑦
难度: 简单查看答案及解析
-
下列各组晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.NaCl与HCl C.CO2与H2O D.CCl4与KCl
难度: 简单查看答案及解析
-
下表中给出几种氯化物的熔点和沸点:
NaCl
MgCl2
AlCl3
SiCl4
熔点/℃
801
714
190
-70
沸点/℃
1413
1412
180
57.57
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化铝晶体是典型的离子晶体。其中与表中数据一致的是( )
A.只有①② B.② C.只有①②③ D.只有②④
难度: 简单查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+
C.深蓝色的透明溶液是硫酸铜溶液
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 简单查看答案及解析
-
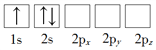
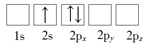
若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了
A.能量最低原则 B.泡利不相容原理
C.洪特规则 D.能量守恒原理
难度: 简单查看答案及解析
-
下列化学式能真实表示物质分子组成的是
A.NaOH B.CO2 C.C D.SiO2
难度: 简单查看答案及解析
-
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材料K3C60
难度: 简单查看答案及解析
-
下列物质熔化时,不破坏化学键的是( )
A.氯化钠 B.水晶 C.金刚石 D.十七烷
难度: 简单查看答案及解析
-
某元素质量数52,中子数28,其基态原子未成对电子数为
A.3 B.4 C.5 D.6
难度: 简单查看答案及解析
-
下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是( )
A.6与16 B.11与17 C.14与8 D.10与19
难度: 简单查看答案及解析
-
碱金属和卤素形成的化合物大多数具有的性质是( )
①高沸点 ②能溶于水 ③水溶液能导电 ④低熔点 ⑤熔融状态不导电
A.①④⑤ B.①②③ C.②③⑤ D.③④⑤
难度: 简单查看答案及解析
-
有关CH2=CH-C≡N分子的说法正确的是
A.3个
键,3个π键 B.4个
键,3个2π键
C.6个
键,2个π键 D.6个
键,3个π键
难度: 简单查看答案及解析
-
下列配合物的配位数是6的是( )
A.K2[Co(SCN)4] B.Fe(SCN)3
C.Na3[AlF6] D.[Cu(NH3)4]Cl2
难度: 简单查看答案及解析
-
在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.Cl2+H2O=HClO+HCl
D.NH4Cl+NaOH
NaCl+NH3↑+H2O
难度: 简单查看答案及解析
-
对于A1型最密堆积的描述错误的是( )
A.A1型最密堆积晶体的晶胞也叫面心立方晶胞
B.面心立方晶胞的每个顶点上和每个面的中心上都各有一个微粒
C.平均每个面心立方晶胞中有14个微粒
D.A1型最密堆积可用符号“…ABCABC…”表示
难度: 简单查看答案及解析
-
x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径
B.x的电负性大于y的电负性
C.x阴离子的半径小于y阳离子的半径
D.x的第一电离能小于y 的第一电离能
难度: 中等查看答案及解析
-
已知铍(Be)的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )
A.单质铍跟冷水反应产生氢气
B.氯化铍分子中铍原子的最外层电子数是8
C.铍的原子半径大于硼的原子半径
D.氢氧化铍的碱性比氢氧化钙强
难度: 简单查看答案及解析
-
下列事实中与氢键的形成有关的是( )
A.水加热到比较高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.HF 、 HCl 、 HBr 、 HI 的热稳定性依次减弱
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
B.NH
和CH4的空间构型相似
C.PH3与
都是平面型分子
D.CO2与H2O都是直线型分子
难度: 简单查看答案及解析
 B.
B.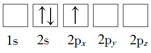
 D.
D.