-
化学与生产、生活、社会密切相关。下列有关说法中正确的是
A.“玉兔号”月球车帆板太阳能电池的材料是氮化硅或二氧化硅
B.新冠肺炎防疫期间,可用酒精消毒,酒精浓度越大消毒效果越好
C.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
D.汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
难度: 中等查看答案及解析
-
二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
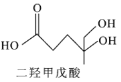
A.二羟甲戊酸是乙酸的同系物 B.能使酸性高锰酸钾溶液褪色
C.能发生加成反应和酯化反应 D.1 mol二羟甲戊酸能跟3 mol NaOH反应
难度: 简单查看答案及解析
-
石蜡是石油减压分馏的产品,某实验小组利用如图的实验探究石蜡油(液态石蜡)分解的部分产物。下列说法正确的是( )
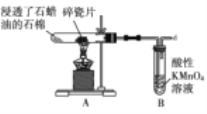
A.石蜡属于油脂
B.该实验证明石蜡油分解产物只有乙烯
C.B中发生氧化反应,所以溶液褪色
D.碎瓷片的作用是防止暴沸
难度: 中等查看答案及解析
-
中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图
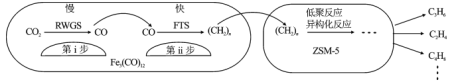
下列说法正确的是
A.第i步反应为CO2+H2=CO+H2O
B.第i步反应的活化能低于第ii步
C.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯的△H减小
D.添加不同助剂后,反应的平衡常数各不相同
难度: 中等查看答案及解析
-
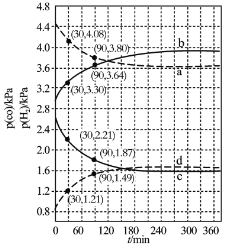
常温下,分别取浓度不同、体积均为20.00 mL的3种HCl溶液,分别滴入浓度为1.0001mol/L、0.1000 mol/L和0.01000 mol/L的NaOH溶液,测得3个反应体系的pH随V(NaOH)变化的曲线如图。在V(NaOH)=20.00 mL前后pH出现突跃。下列说法不正确的是
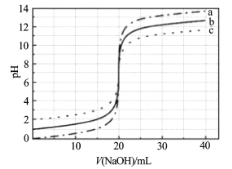
A.曲线a、b、c对应的c(HCl):a=100c
B.曲线a、b、c对应的c(NaOH):a>b>c
C.当V(NaOH)=20.00 mL时,3个体系中均满足:c(Na+)=c(Cl-)
D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家,一种高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1-x)LiFePO4+xFePO4+LixCn
LiFePO4+nC。下列说法错误的是
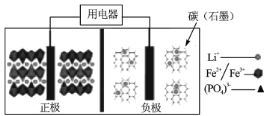
A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,当溶液中通过1 mol e-时,阳极质量减小7g
难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:
D.最高价氧化物的水化物的酸性:
难度: 中等查看答案及解析
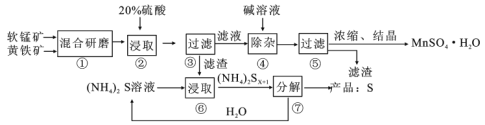
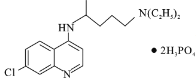 )是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹(
)是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹( )和磷酸在一定条件下制得。氯喹的合成路线如下:
)和磷酸在一定条件下制得。氯喹的合成路线如下: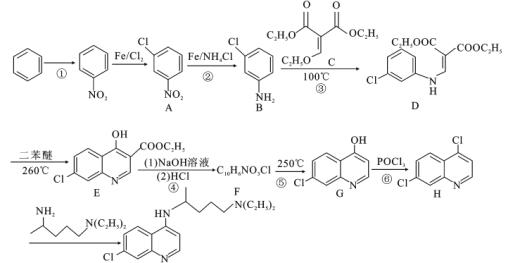
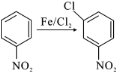 的方程式_______________。
的方程式_______________。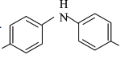 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。