-
化学与生产生活密切相关,下列有关说法中不正确的是
A.酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好
B.酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关
C.泡沫灭火器中用的是小苏打和硫酸铝
D.金属焊接前常用NH4Cl溶液处理焊接处
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.100ºC时,1L pH=6纯水中含H+数目为10-6NA
B.0.1mol·L-1 Na2CO3溶液中,Na+的数目为0.2NA
C.常温常压下,17g羟基(—18OH)所含中子数为9NA
D.标准状况下,22.4L CHCl3中所含C—Cl键的数目为3NA
难度: 中等查看答案及解析
-
中美元首G20峰会确定携手采取积极行动管制芬太尼。芬太尼为一种麻醉、镇痛药物,超剂量使用该药物会导致严重后果,其结构简式如图所示。下列说法正确的是( )
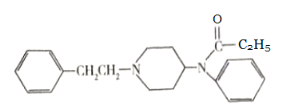
A.芬太尼分子中含有碳碳双键官能团
B.芬太尼分子中所有的碳原子可能共面
C.芬太尼的一氯取代物有13种
D.芬太尼的分子式为C22H22N2O
难度: 中等查看答案及解析
-
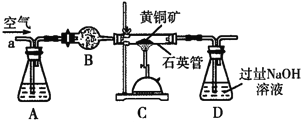
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
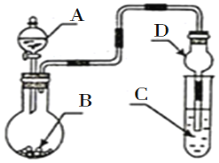
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀,然后沉淀又溶解
C.实验仪器D可以起到防止溶液倒吸的作用
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
难度: 简单查看答案及解析
-
X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的
,下列说法正确的是( )
A.简单离子半径M>W>Z>X
B.M2W2与足量的CO2完全反应,转移2 mol电子时增重28 g
C.X、Z两种元素只能组成化学式为ZX3的化合物
D.由X、Z、W三种元素形成的化合物既有共价化合物也有离子化合物
难度: 中等查看答案及解析
-
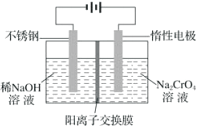
某课题研究小组设计如下图所示装置(电极材料均为铂),该装置可将工业废水中的乙胺(CH3CH2NH2)转化成无毒无害物质。下列分析错误的是
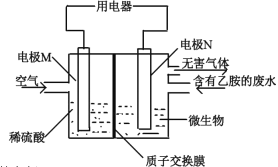
A. 电极N为电池的负极
B. 电池工作时,H+由右极区通过交换膜移动到左极区
C. N电极的电极反应方程式为2CH3CH2NH2+8H2O-30e-=4CO2↑+N2↑+30H+
D. 当空气(假设含氧气20%)的进入量为7.5mol时,可以处理含乙胺9%(质量分数)的废水0.1kg
难度: 中等查看答案及解析
-
已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是
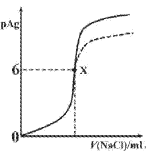
A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
难度: 简单查看答案及解析
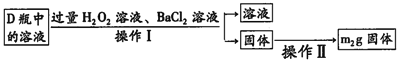
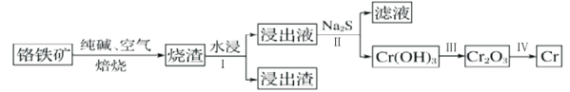
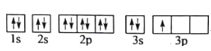
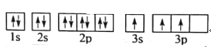
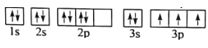
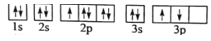
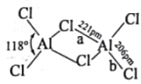
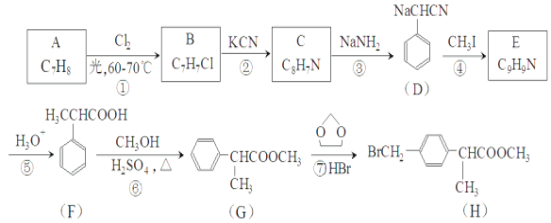
 的合成路线______。
的合成路线______。