-
化学与生产生活密切相关。下列关于化学与生产、生活的说法中不正确的是( )
A.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张
B.土壤胶体中的胶粒带负电,所以更容易吸附带负电的硝酸根离子
C.硫酸亚铁用作为食品的抗氧化剂,利用了亚铁较强的还原性
D.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
有机物M、N分子的模型如图所示,其中不同颜色的球表示不同的原子,原子之间的化学键可以是单键、双键。下列说法错误的是
M
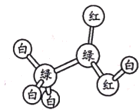 N
N
A.M与HCOOCH3互为同分异构体
B.N的官能团为羟基
C.在与钠的反应中N放出气泡比M快
D.N能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
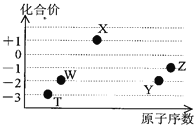
A.X的氢化物具有很强的还原性
B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4
D.元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
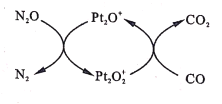
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
难度: 中等查看答案及解析
-
亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲
 乙
乙 丙
丙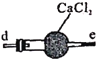 丁
丁
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
难度: 中等查看答案及解析
-
某化学小组设计“全氢电池”如图中甲池(其中a、b为多孔石墨电极),拟用该电池电解处理生活污水,达到絮凝净化的目的。其工作原理示意图:

闭合K工作过程中,下列分析错误的是
A.甲池中a极反应为:H2-2e-+2OH-=2H2O
B.乙池中Fe电极区附近pH增大
C.一段时间后,乙池的两极间出现污染物颗粒沉降现象
D.如果Al电极上附着较多白色物质,甲池中Na+经过交换膜速率定会加快
难度: 中等查看答案及解析
-
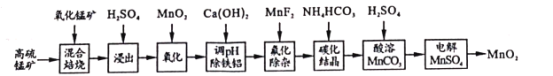
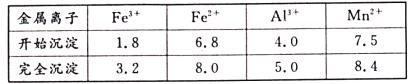
钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:

已知:MoO3,Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。
下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣并加入KSCN,溶液变为血红色
C.步骤③中可以用CO2代替硫酸
D.步骤④中可知Na2MoO4溶解度随温度变化较小
难度: 困难查看答案及解析
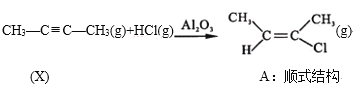 ΔH=akJ/mol(a<0)
ΔH=akJ/mol(a<0) ΔH=bkJ/mol(b<0)
ΔH=bkJ/mol(b<0)

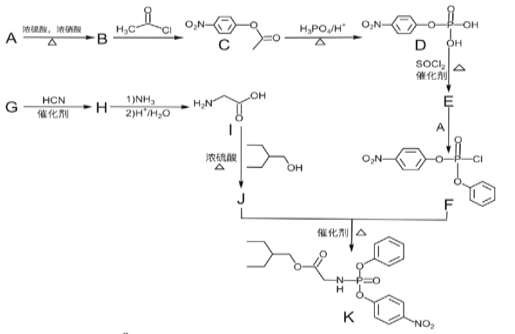
 R—Cl
R—Cl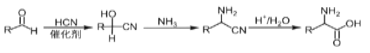
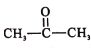 、SOCl2为原料制备
、SOCl2为原料制备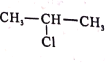 的合成路线(无机试剂任选)___。
的合成路线(无机试剂任选)___。