-
NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 常温常压下,1.4gN2和CO的混合气体含有的电子数为0.7NA
B. 标况下,足量Fe在2.24L氯气中燃烧,反应中转移电子的数目为0.3NA
C. 1L0.1 mol·L-1 醋酸溶液中含有H+离子的数目为0.1NA
D. 一定条件下,将2molSO2和1molO2在密闭容器中充分反应,生成SO3的分子数为2 NA
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 蔗糖、淀粉、蛋白质、油脂都属于高分子化合物
B. 船身上镶锌块能减轻海水对船身的腐蚀,是利用了原电池原理
C. 甲烷燃烧放热,表明的反应物的总能量大于生成物的总能量
D. 医疗上血液透析是利用了胶体的渗析
难度: 简单查看答案及解析
-
下列说法错误的是 ( )
A. 放热反应在常温下不一定能直接发生
B. 需要加热方能发生的反应一定是吸热反应
C. 反应是放热还是吸热须看反应物和生成物具有的总能量的相对大小
D. 吸热反应在一定条件下也能发生
难度: 中等查看答案及解析
-
有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是
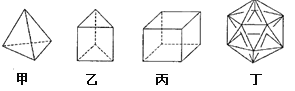
A.1mol甲分子内含有10mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.分子丁显然是不可能合成的
难度: 中等查看答案及解析
-
常温下,Na2CO3溶液中存在平衡:
+H2O
+OH-,下列有关该溶液的说法正确的是
A. Na2CO3在水解过程导致碳酸钠电离平衡被促进
B. 升高温度,平衡向右移动
C. 滴入CaCl2浓溶液,溶液的pH增大
D. 加入NaOH固体,溶液的pH减小
难度: 中等查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A. 由H和Cl形成共价键的过程:

B. Na2O2用于呼吸面具的供氧剂:2Na2O2+2CO2=2Na2CO3+O2
C. 实验室用NH4Cl和Ca(OH)2的混合物制取氨:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
D. 惰性电极电解饱和食盐水的离子方程式:2Cl-+2H2O
2OH-+H2↑+Cl2↑
难度: 简单查看答案及解析
-
金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是( )(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式为Ni2++2e-=Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 中等查看答案及解析
-
某鱼雷采用Al-AgO动力电池,以溶解有氢氧化钾的流动海水为电解液,电池反应为:2Al+3AgO+2KOH=3Ag+2KAlO2+H2O,下列说法不正确的是
A.AgO为电池的正极 B.Al在电池反应中被氧化
C.电子由AgO极经外电路流向Al极 D.溶液中的OH-向Al极迁移
难度: 中等查看答案及解析
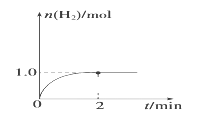
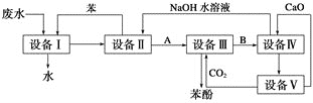
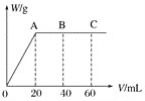
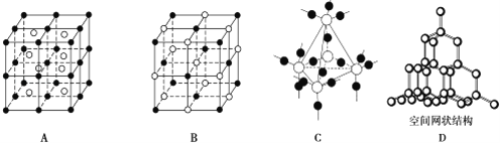
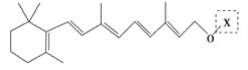
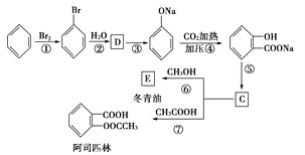
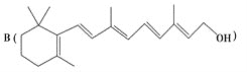 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。