-
下列叙述正确的是( )
A. 反应物总键能大于生成物总键能的反应为吸热反应
B. 燃烧热和中和热的数值都会随反应物的用量不同而改变
C. 中和热测定实验中,为了减少实验误差,必须确保酸碱稀溶液中n(HCl)=n(NaOH)
D. 所有化学反应都可使用催化剂达到降低活化能加快反应速率的目的
难度: 中等查看答案及解析
-
已知CH4气体的燃烧热为802 kJ∙mol-1,1mol CH4不完全燃烧生成CO和H2O(l)时放出的热量为519 kJ。如果1 mol CH4与一定量O2燃烧生成CO、CO2、H2O,并放出731.25 kJ的热量,则一定量O2的质量为
A. 40 g B. 56 g C. 60 g D. 无法计算
难度: 简单查看答案及解析
-
下图各装置中,不能发生原电池反应的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知热化学方程式:
H2O(g)=H2(g)+
O2(g)△H=+241.8kJ·mol-1
H2(g)+
O2(g)=H2O(1)△H=-285.8kJ·mol-1
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ B.吸热44kJ C.放热44kJ D.吸热2.44kJ
难度: 简单查看答案及解析
-
下列有关电化学原理的说法正确的是( )
A.电解法冶炼铝时,阳极反应为:2O2-—4e-=O2↑
B.用电解法精炼铜,阳极反应为:Cu2++2e-=Cu
C.钢铁在中性条件下被腐蚀,正极反应为:2H2O+2e-=H2↑+2OH-
D.铝﹣空气燃料电池以KOH为电解液时,负极反应为:Al﹣3e-=Al3+
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(△H>0),下列图象正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
把1mL0.1mol•L-1的硫酸加水稀释成2L溶液,在此溶液中由水电离产生的H+,接近于
A.1.0×10-4mol/L B.1.0×10-8mol/L
C.1.0×10-10mol/L D.1.0×10-11mol/L
难度: 中等查看答案及解析
-
某原电池结构如图所示,下列有关该原电池的说法正确的是

A.铜棒为负极
B.锌棒质量减轻
C.溶液中阳离子向锌棒移动
D.电子从铜棒经外电路流向锌棒
难度: 简单查看答案及解析
-
下列物质溶于水,由于水解而使溶液呈酸性的是( )
A.P2O5 B.NaHSO4 C.NaF D.CuCl2
难度: 简单查看答案及解析
-
关于物质溶于水的说法不正确的是:
A.溶于水而导电的化合物可以是共价化合物
B.在不饱和溶液中不存在溶解平衡状态
C.氢氧化钠溶于水的过程中存在水合过程,这是一个化学过程
D.氯化铵溶解过程中溶解吸收的热量大于结晶放出的热量
难度: 简单查看答案及解析
-
下列物质属于强电解质的是
A.盐酸 B.水玻璃 C.铜 D.碳酸钙
难度: 简单查看答案及解析
-
浓度均为0.1 mol·L-1的下列溶液,其pH由小到大的排列顺序是
①NaHCO3溶液 ②NaHSO4溶液 ③NaCl溶液 ④AlCl3溶液 ⑤NaClO溶液
A.①<②<③<④<⑤ B.④<②<①<③<⑤
C.②<④<③<①<⑤ D.②<④<①<③<⑤
难度: 中等查看答案及解析
-
已知反应:H2(g)+I2(g)
2HI(g) ΔH=-14.8 kJ • mol-1。则反应:HI(g)
H2(g)+
I2(g)的ΔH为
A.-7.4 kJ • mol-1 B.+7.4 kJ • mol-1 C.-14.8 kJ • mol-1 D.+14.8kJ • mol-1
难度: 简单查看答案及解析
-
下列关于电离平衡常数(K)的说法中正确的是( )
A.电离平衡常数(K)越小,表示弱电解质电离能力越弱
B.电离平衡常数(K)与温度无关
C.相同温度下,不同浓度的同一弱电解质,其电离平衡常数(K)不同
D.多元弱酸各步电离平衡常数相互关系为K1<K2<K3
难度: 中等查看答案及解析
-
原电池的正极一定是( )
A.电子流出的极 B.电子流入的极
C.发生氧化反应的极 D.电极自身参与反应的极
难度: 简单查看答案及解析
-
在密闭系统中有反应C(s)+CO2(g)
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度 ③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2使得压强增大
A. ①②③⑥ B. ①②④⑥ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列各组粒子中只具有还原性的是( )
A.F-、SO2、K B.Na、Zn、I-
C.Fe3+、NO
、SO
D.Fe2+、O2、H2O2
难度: 简单查看答案及解析
-
下列化学用语中正确的是 ( )
A.CO2电子式是
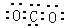
B.次氯酸的结构式为H—Cl—O
C.N原子的轨道表示式为:
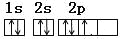
D.硫离子的结构示意图:

难度: 简单查看答案及解析
-
以下列出的是一些原子的2p能级和3d能级中电子排布的情况,其中违反洪特规则的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列化合物中阳离子和阴离子电子层结构相同的是
A.NaCl B.MgF2 C.CaF2 D.K2O
难度: 简单查看答案及解析

 Fe(OH)2+ Ni(OH)2。
Fe(OH)2+ Ni(OH)2。