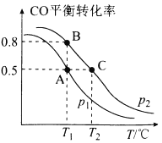
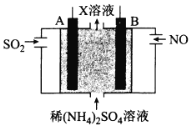
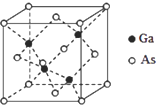
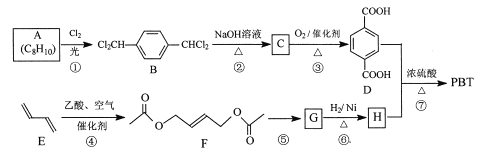
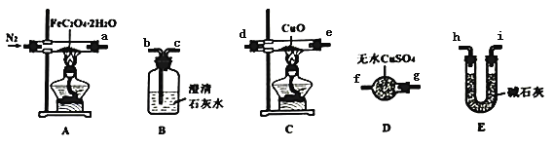
-
化学与环境生活息息相关。下列叙述错误的是
A. 可用淀粉溶液检验食盐中是否加碘
B. 酿酒工业中使用的“酒曲”是一种酶
C. 可用蒸馏法、电渗析法淡化海水
D. 燃煤中加入生石灰可降低含硫化合物的排放
难度: 简单查看答案及解析
-
下列操作能达到实验目的的是( )
目的
操作
A
制备无水氯化铝
将SOCl2 与AlCl3.6H2O
B
制备乙酸乙酯
在试管中先加2mL浓硫酸,再加入2mL乙醇和乙酸,连接好装置加热
C
配制硝酸银溶液
将硝酸银固体溶于适量自来水
D
测定次氯酸钠的pH
用玻璃棒蘸去溶液,点在湿润的pH试纸上
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关有机物的说法不正确的是( )
A.氯乙烯分子中所有原子共平面 B.乙醇、乙酸都能发生取代反应
C.乙酸乙酯、甲酸丙酯的密度都小于水 D.淀粉和纤维素互为同分异构体
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下3.6gH2O含有的电子数为2NA
B.2.8g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C.0.lmolCl2与足量的铁粉充分反应转移的电子数为0.2NA
D.1L0.2mol/l的K2SO3溶液中SO
的数目为0.2NA
难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:
D.最高价氧化物的水化物的酸性:
难度: 中等查看答案及解析
-
新能源汽车上有一种质子交换膜燃料电池,其工作原理如图所示,下列叙述正确的( )

A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
室温下,向10mL0.1mol•L-1HX溶液中逐滴加入0.2mol•L-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( )

A.HX为一元强酸,YOH为一元弱碱
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(H+)>c(OH-)
D.25℃时pH=a的YX溶液中水电离出的c(H+)=1.0×10-amol•L-1
难度: 中等查看答案及解析