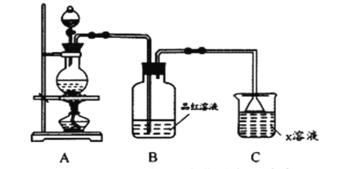
-
下列关于化学与生产、生活的认识正确的是( )
A.利用地热、潮汐等能源替代化石燃料符合环保理念
B.绿色食品就是不使用化肥农药,不含任何化学物质的食品
C.采用增大臭氧浓度来改善空气质量
D.用Ba(OH)2处理含Cu2+的废水,可消除水中重金属离子的污染
难度: 简单查看答案及解析
-
下列分析正确的是( )
A.异丁烷的二氯代物有4种
B.误食少量硫酸铜,可大量饮入牛奶解毒
C.石蜡油分解产物均能使酸性KMnO4溶液褪色
D.CH3-CH=CH2中所有原子共平面
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )
A.2.0gH218O和D2O的混合物中含有质子数为NA
B.1.0L 2.0 mol/L NaOH溶液中含有氧原子数为2NA
C.3.4gH2O2参加氧化还原反应时转移电子数一定为0.1NA
D.常温下,1mol的NaHSO4晶体中含阳离子数目为2NA
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不一定正确的是( )
A.原子半径:X>Y>Z>W
B.Y位于第三周期第ⅢA族
C.W和X组成的化合物为碱性氧化物
D.向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清
难度: 中等查看答案及解析
-
下列实验过程中的相关步骤正确的是
选项
实验
操作
A
检验Fe(NO3)2晶体是否变质
将样品溶于稀硫酸,滴入几滴KSCN溶液
B
验证Mg(OH)2 和Fe(OH)3的Ksp大小
取2mL 1.0mol/L NaOH 溶液,先滴3 滴1.0mol /L MgCl2溶液,再滴3 滴1.0mol/L FeCl3溶液
C
比较醋酸和碳酸酸性强弱
pH 计分别伸入0.1mol/L CH3COONa 溶液和0.1mol/LNa2CO3溶液中,读取pH
D
测定中和反应反应热
混合前分别用冲洗干净的温度计测量50mL0.50mol/L HCl溶液与50mL 0.55mol/L NaOH 溶液的温度
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C
Li1-xCoO2+LixC6。示意图如右。下列说法正确的是
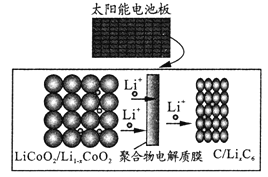
A.充电时,阳极的电极反应式为 Li1-xCoO2 +xLi++xe-=LiCoO2
B.该装置工作时涉及到的能量形式有3种
C.充电时锂离子由右向左移动
D.放电时,正极质量增加
难度: 中等查看答案及解析
-
常温下,CH3COOH和NH3.H2O的电离常数均为1.8×10-5mol/L。向20mL浓度均为0.1mol/LNaOH和NH3.H2O的混合液中滴加等浓度的CH3COOH溶液,所得混合液的相对导电能力与加入CH3COOH溶液的体积(V)关系如图所示。下列说法正确的是( )
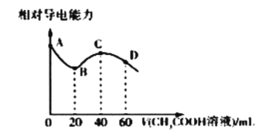
A.由A点溶液到B点溶液相对导电能力降低主要是因为离子的总物质的量减少
B.A、B、C、D四点溶液中B点溶液中水的电离程度最大
C.C点溶液呈碱性
D.D点溶液中存在: c(Na+)>c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
难度: 困难查看答案及解析