-
已知NA是阿伏伽德罗常数的值,下列说法错误的是( )
A.将1 molNH4NO3溶于稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
B.室温下,1L pH=3的NaHSO3水溶液中由水电离产生的OH-的数目为0.001NA
C.常温常压下,40 g SiC中含有Si—C键数目为4NA
D.100 g 质量分数为3%的甲醛水溶液中含有的氢原子数目大于0.2NA
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法错误的是( )
A.硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂
B.厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大
C.酒精能使蛋白质变性,预防新冠肺炎病毒使用的酒精纯度越高越好
D.使用氯气对自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害
难度: 简单查看答案及解析
-
甲、乙、丙三种有机化合物的键线式如图所示。下列说法错误的是
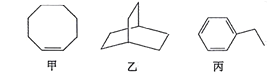
A.甲、乙的化学式均为C8H14
B.乙的二氯代物共有7种(不考虑立体异构)
C.丙的名称为乙苯,其分子中所有碳原子可能共平面
D.甲、乙、丙均能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的
。下列说法正确的是( )
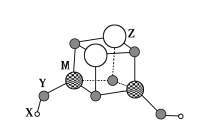
A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
难度: 简单查看答案及解析
-
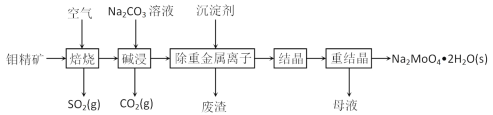
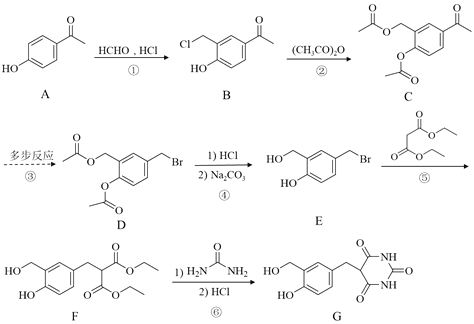
我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是
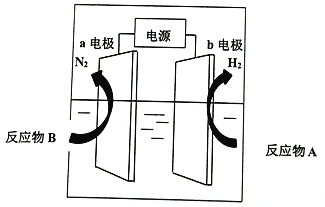
A.a为阳极,CO(NH2)2发生氧化反应
B.b电极反应为:2H2O+2e-=H2↑+2OH-
C.每转移6mol电子,a电极产生1molN2
D.电解一段时间,a极区溶液pH升高
难度: 中等查看答案及解析
-
下列实验中,由现象得出的结论正确的是( )
选项
操作和现象
结论
A
将3体积SO2和1体积O2混合通过灼热的V2O5充分反应,产物依次通过BaCl2溶液和品红溶液,前者产生白色沉淀,后者褪色
SO2和O2的反应为可逆反应
B
用洁净的玻璃棒蘸取少量某溶液进行焰色反应,火焰为黄色
该溶液为钠盐溶液
C
向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液呈黄色
原溶液中含有I-
D
用浓盐酸和石灰石反应产生的气体通入Na2SiO3溶液中,Na2SiO3溶液变浑浊
C元素的非金属性大于Si元素
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
四甲基氢氧化铵[(CH3)4NOH]是强碱,常温下甲胺(CH3NH2·H2O)的电离常数为Kb,且pKb=-lgKb=3.38。常温下,在体积均为20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液和甲胺溶液,分别滴加浓度为0.1mol·L-1的盐酸,溶液的导电率与盐酸体积的关系如图所示。
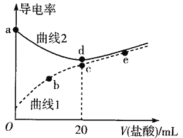
下列说法正确的是
A.曲线1代表四甲基氢氧化铵溶液
B.常温下,CH3NH3Cl水解常数的数量级为10-11
C.b点溶液中存在c(H+)=c(OH-)+c(CH3NH2·H2O)
D.在b、c、e三点中,水的电离程度最大的点是e
难度: 中等查看答案及解析