-
化学与生活密切相关,下列说法不正确的是( )
A.分别用液化石油气、汽油、地沟油加工制成的生物柴油都是碳氢化合物
B.电解食盐水制取次氯酸钠喷洒房间能杀死新冠肺炎病毒
C.医用“纳米银外用抗菌凝胶”外用于皮肤后,能够缓释放出纳米银离子,抑制并杀灭与之接触的病菌并有促进皮肤愈合的作用。
D.液氯罐泄漏时,可将其移入水塘中,并向水塘中加入熟石灰
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是( )
选项
实验
现象
结论
A
向0.1mol/LFeCl2溶液中加入1滴KSCN溶液,再滴加氯水
开始无明显现象,滴加氯水后溶液变红
氧化性:Cl2>Fe3+
B
向某钠盐中滴加盐酸,产生的气体通入品红溶液
品红溶液褪色
该钠盐可能为Na2S2O3
C
乙烯通入中性KMnO4溶液中
溶液褪色并产生黑色沉淀
乙烯具有还原性
D
将苯加入橙色的溴水中振荡并静置
下层液体几乎无色
苯与Br2发生了
取代反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol BaCl2晶体中所含离子总数为0.1NA
B.25℃时,pH=1的HCl溶液中含有H+ 的数目为0.1NA
C.l7g H2O2中含有非极性键数目为0.5NA
D.生成2.33 gBaSO4沉淀时,转移电子数目为0.01NA
难度: 中等查看答案及解析
-
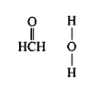
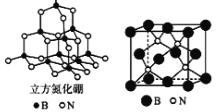
现有短周期主族元素R、X、Y、Z。若它们的最外层电子数用n表示,则有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。这四种元素组成一种化合物Q,Q具有下列性质:

下列说法错误的是
A.原子半径:Y>Z>X B.最高价氧化物对应水化物酸性:Y<Z
C.X和Y组成的化合物在常温下都呈气态 D.Y3Z4是共价化合物
难度: 中等查看答案及解析
-
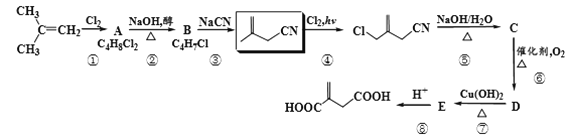
下图为有机物M、N、Q的转化关系,有关说法正确的是( )
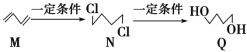
A.M生成N的反应类型是取代反应 B.可用酸性KMnO4溶液区分N与Q
C.N的同分异构体有6种 D.0.3 mol Q与足量金属钠反应生成6.72L H2
难度: 中等查看答案及解析
-
厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示 (图中 HA 表示乳酸分子,A - 表示乳酸根离子) 。下列说法正确的是( )
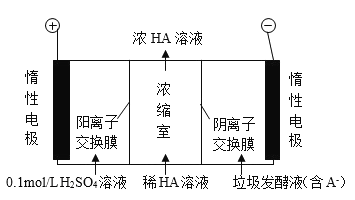
A.通电后,阳极附近 pH 增大
B.电子从负极经电解质溶液回到正极
C.当电路中通过 2mol 电子的电量时,会有 1mol 的 O2 生成
D.通电后, A- 通过阴离子交换膜从阴极进入浓缩室
难度: 中等查看答案及解析
-
某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的 物质的量分数与溶液pH的关系如图乙所示,(已知HA=H++HA- HA-
H++A2-)则下列说法中正确的是( )
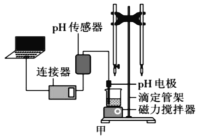
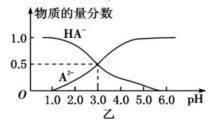
A.pH=3.0时,可以计算出Ka2= 10 -3
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验左边的滴定管为碱式滴定管,用来盛装NaOH溶液,烧杯中并加酚酞作指示剂
D.常温下,将等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
难度: 中等查看答案及解析
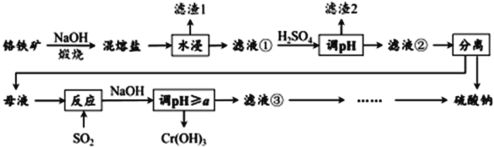
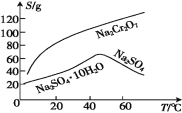
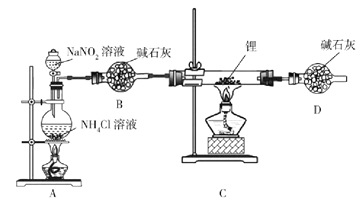
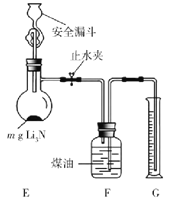
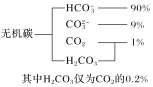


 R-CH2COONa+NH3
R-CH2COONa+NH3