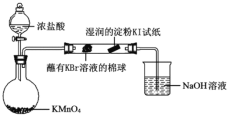
-
不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
难度: 简单查看答案及解析
-
X、Y、Z 均为元素周期表中前20号元素,Xb+、Yb−、Z(b+1)−三种简单离子的电子层结构相同,下列说法正确的是( )
A.原子半径:Z > Y > X
B.离子半径:Yb− > Z(b+1)− > Xb+
C.Z(b+1)−的还原性一定大于Yb−
D.气态氢化物的稳定性:Hb+1Z > HbY
难度: 中等查看答案及解析
-
应用元素周期律分析下列推断,其中正确的组合是( )
①第ⅡA族单质的熔点随原子序数的增大而降低
②砹(At)是第VIIA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱
④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③⑥ B.②④⑥ C.③④⑤ D.①③④
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是原子半径最小的原子, Y原子最外层电子数是其内层电子总数的3倍,W原子的核电荷数等于X、Z原子核电荷数之和,X和Z同主族。下列说法正确的是
A. 工业上用电解熔融W的氯化物制备W的单质
B. 单质Z着火,可以用泡沫灭火器进行扑灭
C. 最高价氧化物对应水化物的碱性:W>Z
D. X、Y只能形成一种化合物
难度: 中等查看答案及解析
-
工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O2⇌2SO3(正反应放热),下列有关说法正确的是
A. 升高温度只提高逆反应速率
B. 降低温度可提高正反应速率
C. 使用催化剂能显著增大反应速率
D. 达到化学平衡时正、逆反应速率相等且等于0
难度: 简单查看答案及解析
-
下列关于元素周期表的叙述正确的是
A.周期表中有8个A族,8个B族
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1-20号元素
D.原子及其离子的核外电子层数都等于该元素所在的周期数
难度: 简单查看答案及解析
-
随着碱金属元素原子序数的增大,下列递变规律正确的是
A.原子半径逐渐增大 B.最高价氧化物对应水化物的碱性逐渐减弱
C.单质熔、沸点逐渐升高 D.单质的还原性逐渐减弱
难度: 简单查看答案及解析
-
同周期的X、Y、Z三种元素,它们的气态氢化物的化学式分别为H2X、YH3、ZH4 ,下列说法正确的是( )
A. 气态氢化物的稳定性按X、Y、Z的顺序递增
B. 三种元素的最高价氧化物对应的水化物酸性:H2ZO3>H3YO4>H2XO4
C. 元素的最高正化合价按X、Y、Z的顺序递增
D. 元素原子的半径按X、Y、Z的顺序递增
难度: 中等查看答案及解析
-
下列化学用语表达正确的是( )
A.CO2的结构式:O-C-O B.HClO的电子式:H:O:Cl
C.NH4Cl 的电子式为:
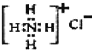 D.中子数为8的氮原子:
D.中子数为8的氮原子:难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.CH4和BCl3分子中所有原子的最外层都达到了8电子稳定结构
B.Na2O2、NaOH中所含化学键类型不完全相同
C.Li在氧气中燃烧主要生成Li2O2
D.氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
难度: 简单查看答案及解析
-
下列说法正确的是
A.
、
、
是三种不同的核素
B.
和
互为同位素
C.
、
互为同素异形体
D.同一元素形成的不同微粒具有相同的化学性质
难度: 中等查看答案及解析
-
铅蓄电池是最早使用的充电电池。目前汽车上使用的电瓶大多数仍是铅蓄电池,其电池反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是
A.该电池放电过程中,溶液的pH值增大
B.放电时,电池的负极反应为:Pb-2e-= Pb2+
C.该电池的充、放电过程互为可逆反应
D.放电过程中,电子的流向为:负极→导线→正极→H2SO4溶液
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g)⇌CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是
A.
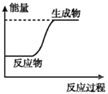
B.
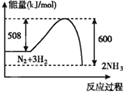
C.
D.

难度: 简单查看答案及解析
-
下列说法正确的是
A.H2O2中既有离子键又有共价键
B.HCl溶于水能电离出H+和Cl−,所以HCl是离子化合物
C.干冰熔化破坏共价键和分子间作用力
D.PCl3分子中每个原子的最外层都具有8电子的稳定结构
难度: 中等查看答案及解析
-
已知R2+核内共有N个中子,R的质量数为A,m g R2+中含电子的物质的量为( )
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(g)反应放出的热量为483.6 kJ。有关键能数据如表所示:则水分子中O—H键键能为( )
化学键
H-H
O=O
键能/(kJ·mol-1)
436
498
A.463.4 kJ·mol-1 B.926.8 kJ·mol-1 C.221.6 kJ·mol-1 D.413 kJ·mol-1
难度: 简单查看答案及解析
-
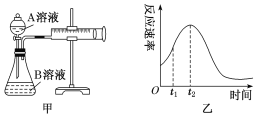
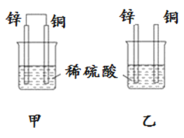
图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
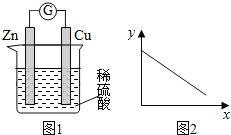
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
难度: 中等查看答案及解析
-
一定条件下,对于反应N2(g)+3H2 (g)
2NH3(g)来说,下列反应速率中最快的是( )
A. V(H2)=0.6mol/(L·min) B. V(H2)=0.01 mol/(L·s)
C. V(N2)=0.3 mol/(L·min) D. V(NH3)=0.5 mol/(L·min)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H2(g)+I2(g) ⇌ 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) ⇌ H2(g)+CO(g),气体的总物质的量不再改变不能说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) ⇌ 2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2等于Q1
难度: 困难查看答案及解析