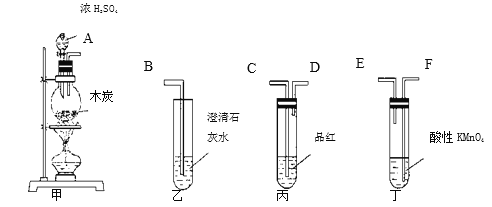
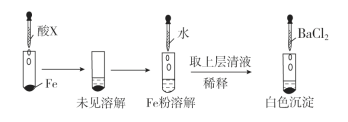
-
下列表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
C. 浓硫酸具有吸水性,故能使蔗糖炭化
D. SO2能使酸性KMnO4溶液褪色,体现了SO2的漂白性
难度: 中等查看答案及解析
-
如表所示有关物质检验的实验结论正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向某溶液中加入盐酸,将生成气体通入澄清石灰水中,
澄清石灰水变浑浊
该溶液一定含有CO32-
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
向某溶液中加入浓NaOH溶液并加热,生成气体使湿润的红色石蕊试纸变蓝
该溶液一定含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
你认为减少酸雨产生可采用的措施是( )
①少用煤作燃料 ②把工厂烟囱加高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
难度: 简单查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A.Fe2(SO4)3 B.Na2CO3 C.KNO3 D.FeSO4
难度: 简单查看答案及解析
-
为了说明影响化学反应快慢的因素,某同学分别设计了如下A~D四个实验,你认为结论不正确的是( )
A.将大小、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
难度: 简单查看答案及解析
-
下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是( )



A.4.03米大口径碳化硅反射镜
B.2022年冬奥会聚氨酯速滑服
C.能屏蔽电磁波的碳包覆银纳米线
D.“玉兔二号”钛合金筛网轮
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是( )
A.节约用水用电 B.利用风力发电
C.增加植被面积 D.燃烧煤炭供热
难度: 简单查看答案及解析
-
下列有关化学反应中能量变化的理解,正确的是( )
A.凡是伴随能量变化的过程都是化学变化
B.在化学反应过程中总是伴随着能量的变化
C.在确定的化学反应中反应物的总能量一定等于生成物的总能量
D.在确定的化学反应中反应物的总能量总是高于生成物的总能量
难度: 简单查看答案及解析
-
下列物质中,属于纯净物的是( )
①陶瓷 ②水泥 ③玻璃 ④漂白粉 ⑤胆矾 ⑥氨水 ⑦液氨
A.①③⑤ B.②④⑥ C.⑤⑦ D.⑥⑦
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
难度: 中等查看答案及解析
-
对于反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g),下列叙述不正确的是( )
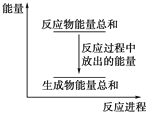
A.其反应物或生成物都能用来表示该反应的速率
B.反应过程中能量关系可用上图表示
C.若将该反应设计成原电池,锌为负极
D.若设计为原电池,当有32.5 g锌溶解,标准状况下正极放出11.2 L气体
难度: 中等查看答案及解析
-
对下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定
C.常温下浓硫酸、浓硝酸可以用铝罐贮存,说明浓硫酸、浓硝酸与铝不反应
D.反应CuSO4+H2S=CuS↓+H2SO4说明硫化铜既不溶于水,也不溶于稀硫酸
难度: 简单查看答案及解析
-
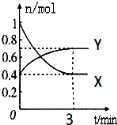
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
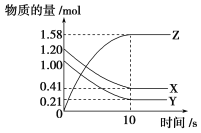
A.反应的化学方程式为:X(g)+Y(g)⇌Z(g)
B.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
C.反应开始到10s,X的物质的量浓度减少了0.79mol·L-1
D.反应开始到10s,Y的转化率为79.0%
难度: 简单查看答案及解析
-
燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )
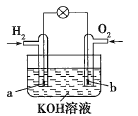
A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
难度: 中等查看答案及解析
-
工业利用冶铜的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制X的生产流程示意图如图:
炉渣
滤液
沉淀
X,则X的化学式为( )
A.SiO2 B.Al2O3 C.Fe2O3 D.FeO
难度: 简单查看答案及解析
-
下列各组离子中,能在水溶液中大量共存的是
A.Na+、Ag+、Cl-、CO
B.Na+、Mg2+、Cl-、SO
C.Fe3+、K+、SO
、OH- D.Fe2+、H+、SO
、NO
难度: 简单查看答案及解析
-
NH3是一种重要的化工原料,可以制备一系列物质(如图所示)。下列有关表述正确的是( )

A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.NH3与HCl反应属于氧化还原反应
难度: 简单查看答案及解析
-
在2L密闭容器中,在一定条件下发生A(g)+3B(g)
2C(g),在10s内反应物A的浓度由1mol/L降到0.6mol/L,则ν(C)为
A.0.04mol/(L·s) B.0.08mol/(L·s)
C.0.4mol/(L·s) D.0.8mol/(L·s)
难度: 中等查看答案及解析
-
工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是( )
A. Cu
Cu(NO3)2
B. Cu
CuO
Cu(NO3)2
C. Cu
Cu(NO3)2
D. Cu
Cu(NO3)2
难度: 中等查看答案及解析
-
在密闭容器中进行X2(g)+2Y2(g)
Z(g)的反应,X2、Y2、Z的起始浓度依次为0.2 mol/L、 0.3 mol/L、0.3 mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
A.c(Z)=0.45 mol/L B.c(X2)=0.3 mol/L c(Z)=0.1 mol/L
C.c(X2)=0.5 mol/L D.c(Y2)=0.5 mol/L
难度: 中等查看答案及解析