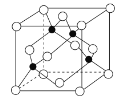
-
化学与生活、材料、环保、科研等都有着密切的联系。下列说法正确的是( )
A.蛋白质加热变性后,不能水解为氨基酸而被人体吸收利用
B.中国电科38所研发的运算性能最强的“魂芯二号A”芯片,主要成分为二氧化硅
C.核素14C可以用于软躯体化石库的科研考古
D.化石燃料和工业尾气进行脱硫、脱硝处理,均能有效缓解温室效应
难度: 简单查看答案及解析
-
查耳酮常用作有机合成试剂和指示剂,其结构如图所示。下列说法错误的是( )
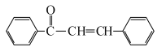
A.查耳酮的分子式为C15H12O
B.查耳酮分子中所有的碳原子可能共平面
C.查耳酮能发生加聚反应制备高分子
D.查耳酮的同分异构体中含有碳氧双键、碳碳双键且两苯环不直接相连的共有6种(不考虑立体异构)
难度: 中等查看答案及解析
-
A、B、C、D为原子序数依次增大的四种短周期主族元素。D的单质常温下为黄绿色气体,输送D的单质的管道若发生泄漏,用A与B形成的化合物检查时会生成B的单质,并产生大量白烟;C与A可形成A2C、A2C2两种常见化合物;E的合金是目前生产和使用量最大的金属材料。下列说法错误的是( )
A.原子半径:B>C,最高价氧化物对应水化物的酸性:D>B
B.由A、B、C三种元素形成的多种化合物,均只含共价键
C.常温下,可以用E单质制成的容器来盛放浓ABC3溶液
D.加热条件下,E单质与D单质的反应产物,溶于A2C所得溶液可继续与E单质反应
难度: 中等查看答案及解析
-
制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
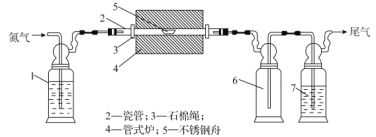
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
难度: 中等查看答案及解析
-
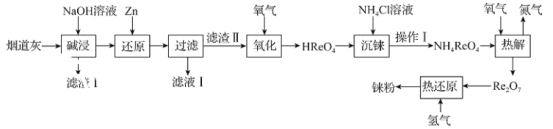
碳酸锶(SrCO3)可用于制造彩电阴极射线管、荧光玻璃等。以天青石(主要含有SrSO4和少量MgCO3杂质)为原料生产SrCO3的流程如图:
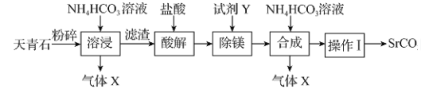
下列说法错误的是( )
A.锶的金属性比钙的强,所以SrSO4的溶解性比CaSO4的强
B.气体X和SO2均为酸性氧化物,且均能使紫色石蕊试液变红
C.“除镁”时,试剂Y可以选用苛性钠
D.“操作I”的母液经蒸发浓缩、冷却结晶可得到铵态氮肥
难度: 中等查看答案及解析
-
室温下,用0.1mol·L-1的盐酸滴定10mL0.1mol·L-1的Na2SO3溶液,滴定曲线如图所示(不考虑滴定过程中SO2的逸出)。下列说法错误的是( )
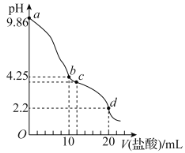
A.a点由水电离出的氢离子浓度大于d点由水电离出的氢离子浓度
B.0.05mol·L-1NaHSO3溶液的pH=4.25
C.c点时,c(Na+)>c(Cl-)>c(HSO
)>c(H+)>c(OH-)
D.d点时,c(H2SO3)>c(HSO
)>c(SO
)>c(H+)>c(OH-)
难度: 中等查看答案及解析
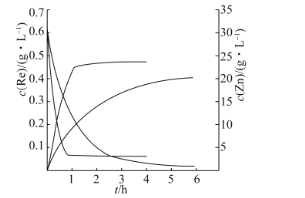
-
我国科研工作者发展了阴极还原电沉积制备高性能氧化铈电极材料的新方法。以石墨为电极,经历以下过程:①在电场的作用下,将电解液中的硝酸根离子插入石墨层间;②改变电流方向,已插入的和到达电极附近的NO3-放电,产生OH-和NO
;③OH-与Ce3+结合形成氢氧化铈,氢氧化铈进一步失水氧化形成氧化铈(CeO2)。图示如图。已知298K时,Ksp[Ce(OH)3]=1×10-20,当离子浓度≤10-5mol·L-1时,可认为沉淀完全。下列说法错误的是( )
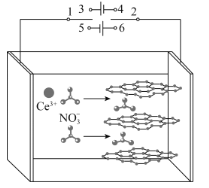
A.过程①,1接3,2接4;过程②,1接5,2接6
B.过程②,阴极电极反应为NO
+H2O+2e-=2OH-+NO
C.室温下,要保证电解液中Ce3+沉淀完全,阴极附近溶液的pH应不小于9
D.过程③,发生的反应为Ce3++3OH-=Ce(OH)3↓,4Ce(OH)3+O2=4CeO2+6H2O
难度: 困难查看答案及解析

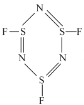 ),SNF发生聚合生成三聚分子B(
),SNF发生聚合生成三聚分子B(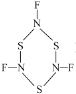 ),分子A中σ键与π键数目之比为___,分子B中氮原子价电子空间构型为___。
),分子A中σ键与π键数目之比为___,分子B中氮原子价电子空间构型为___。